ГЛАВЫ СТРАН ЕАЭС ОДОБРИЛИ НЕОБХОДИМЫЕ
ДЛЯ СОЗДАНИЯ ЕДИНОГО РЫНКА ЛС ДОКУМЕНТЫ
В Евразийской экономической комиссии отметили, что принятие пакета документов позволит обеспечить возможность доступа лекарств на общий рынок с использованием единой процедуры их регистрации.
20.09.2020 г.
Главы правительств стран Евразийского экономического союза в ходе заседания Евразийского межправительственного совета (ЕМПС) одобрили пакет документов, необходимых для запуска общего рынка лекарственных средств в государствах Союза.
«Есть принципиальные договоренности о том, как мы будем идти общему рынку лекарственных средств. Сегодня принято решение, что сначала мы создадим свободу для передвижения всех лекарственных средств на нашей территории. Затем будут урегулированы вопросы, связанные с госзакупками. Мы также пришли к пониманию относительно того, как страны будут регулировать у себя вопрос взаимозаменяемости лекарств. Это позволит усилить конкуренцию и может способствовать понижению цен на лекарства», – заявил председатель коллегии Евразийской экономической комиссии Тигран САРКИСЯН.
eurasiancommission.org
Фото: russia.polpred.com.
ВРАЧИ-МИЛЛИОНЕРЫ: ФАРМКОМПАНИИ РАСКРЫЛИ
ВЫПЛАТЫ МЕДРАБОТНИКАМ В РОССИИ
 Фото: Андрей Луковский / «Коммерсантъ»
Фото: Андрей Луковский / «Коммерсантъ»
ПЕРЕМЕЩЕННЫЕ ЦЕННОСТИ
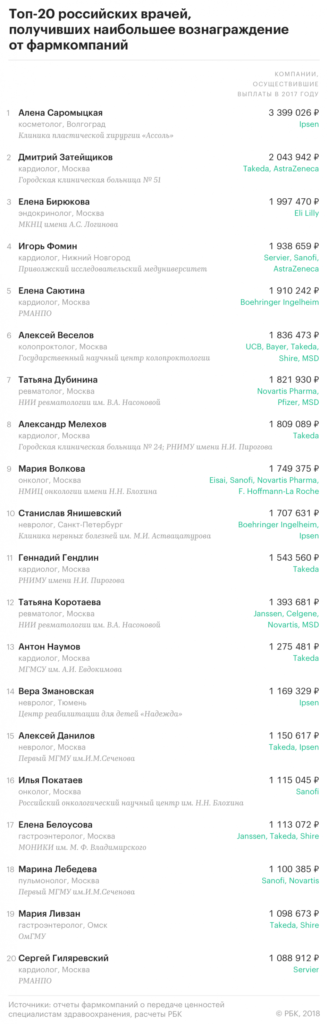
Около 41 тысячи российских врачей в 2017 году, как подсчитал РБК, получили от компаний фарминдустрии более 3,3 млрд руб. При этом 25 из них заработали более 1 млн руб. каждый.
РБК составил топ-20 российских врачей, получивших в прошлом году наибольшие выплаты от производителей лекарств. Эти расчеты сделаны на основе отчетов 36 международных фармацевтических компаний об их выплатах в 2017 году российским врачам и организациям здравоохранения.
Такие данные уже третий год подряд раскрывают фармпроизводители, работающие на российском рынке и входящие в Ассоциацию международных фармацевтических производителей (AIPM). Это отраслевое объединение, в свою очередь, является членом Европейской федерации фармацевтической промышленности и ассоциаций, которая обязывает своих участников публиковать ежегодные отчеты о так называемой передаче ценностей. В них, в частности, указывается, какую сумму и за какую услугу получил конкретный врач. Это может быть оплата регистрационных взносов за участие специалиста в конференции, компенсация ему транспортных расходов, вознаграждение за оказанную консультацию. Отчитаться о таких выплатах члены AIPM должны были до 30 июня.
В прошлом году 36 фармкомпаний перечислили в адрес как минимум 41 тысячи специалистов свыше 3,3 млрд руб., подсчитал РБК. При этом детально расписаны выплаты только 8 тысячам врачей: вместе они получили около 545 млн руб. По остальным специалистам информация приводится только в общем виде, поскольку они не согласились раскрывать свои данные.
Самой щедрой из опубликовавших отчеты фармкомпаний оказалась французская Ipsen: она перечислила в 2017 году российским врачам более 471 млн руб. Средняя выплата каждому специалисту тем самым составила 355 тысяч руб. Наименьшие суммы, согласно расчетам РБК, выплатили британская GSK и американская Celgene: 2,4 млн и менее 2 млн руб. соответственно. При этом минимальный средний «чек» оказался у венгерской Egis — 23 тыс. руб. при общих выплатах 75,8 млн руб. Имена 3,3 тысяч работников здравоохранения, с которыми сотрудничает компания, не раскрываются. Для сравнения: у GSK и Celgene средний платеж равняется 110 тысяч и 70 тысяч руб.
Сопоставимо с Германией
Россия является крупным и значимым рынком для международных фармпроизводителей. Это подтверждают, к примеру, отчеты американской AbbVie о передаче ценностей специалистам здравоохранения в разных странах.
В России она выплатила в 2017 году, как минимум, 557 российским врачам, это почти 54 млн руб. При этом подробно раскрываются лишь платежи 126 специалистам на 8,6 млн руб. В Германии фармпроизводитель перечислил 1,4 тысяч врачам €1,5 млн, что соответствует 99 млн руб. по среднему курсу ЦБ за прошлый год. В немецком отчете детализированы выплаты 796 специалистам на €1,1 млн (72,6 млн руб.).
В Финляндии AbbVie заплатила в 2017 году 309 врачам €328 тыс. (21,7 млн руб.), из них подробно расписаны взаимоотношения с 295 специалистами, получившими €321 тыс. (21,2 млн руб.).
В Польше компания профинансировала 210 врачей, из которых 80 дали согласие на подробное раскрытие информации. Выплаты составили 289 тыс. и 164 тыс. злотых, что соответствует 4,5 млни 2,5 млн руб.
Список миллионеров
Выплаты 1 млн руб. и более получили 25 российских специалистов, причем восемь из них – кардиологи, свидетельствуют расчеты РБК. Возглавила получившийся рейтинг врач столичной косметологической клинки Professional Алена САРОМЫЦКАЯ, которой французская Ipsen в прошлом году заплатила (в основном, за оказанные услуги и консультации) почти 3,4 млн руб. Правда, в своем отчете производитель местом работы специалиста, являющегося сертифицированным тренером Ipsen, указал волгоградскую клинику пластической хирургии «Ассоль».
 Саромыцкая подтвердила РБК, что получает гонорары от Ipsen, отказавшись уточнить сумму гонорара за отдельную лекцию или участие в конференции. «Я не подсчитывала, сколько в целом получила от этой компании, – заявила косметолог. – Я сотрудничаю с несколькими компаниями, я – международный тренер, вхожу в ТОП-10 и читаю лекции не только в России, но и за рубежом».
Саромыцкая подтвердила РБК, что получает гонорары от Ipsen, отказавшись уточнить сумму гонорара за отдельную лекцию или участие в конференции. «Я не подсчитывала, сколько в целом получила от этой компании, – заявила косметолог. – Я сотрудничаю с несколькими компаниями, я – международный тренер, вхожу в ТОП-10 и читаю лекции не только в России, но и за рубежом».
Подобное сотрудничество с фармкомпаниями взаимовыгодно, говорит Саромыцкая. По ее словам, в большей степени в нем заинтересованы именно производители лекарств. Специалистам, к мнению которых прислушиваются другие врачи, они готовы платить большие гонорары.
Подтвердил факт получения гонораров от Takeda и AstraZeneca и руководитель сосудистого центра столичной городской клинической больницы № 51 Дмитрий ЗАТЕЙЩИКОВ. Он занимает в рейтинге второе место с 2 млн руб. вознаграждения. Большая часть этих денег уходит на оплату проживания и перелеты, меньшую составляют непосредственно гонорары за лекции. По словам Затейщикова, как правило, вознаграждение за одну лекцию оставляет около 25 тысяч руб. Доход Затейщикова по основному месту работы за прошлый год — 1,4 млн руб.
«Большинство фармкомпаний приглашают прочитать лекции для саморекламы, но некоторые из них, в том числе Takeda и AstraZeneca, организуют лекции для обучения других врачей, когда я, например, рассказываю о заболевании, при котором применяется лекарство компании», — рассказал Затейщиков.
Большая часть денег фармкомпаний уходит на перелеты, констатирует врач Государственного научного центра колопроктологии Алексей ВЕСЕЛОВ (шестое место в рейтинге с суммарным доходом 1,8 млн руб. от пяти компаний). Он объясняет итоговую сумму тем, что часто летает в Сибирь и на Дальний Восток. Во время поездок, по словам Веселова, он читает лекции, проводит мастер-классы по диагностике и лечению воспалительных заболеваний кишечника. Гонорар за одну лекцию — 11–-тысяч руб.
«Дополнительная нагрузка»
Из 36 отчитавших фармпроизводителей все, за исключением «Р-Фарма», являются международными корпорациями. Между тем, согласно данным DSM Group, на российском рынке отечественные производители лекарств по своему количеству лишь незначительно уступают иностранным (600 против 700). В 2017 году российские лекарства занимали 28,5% рынка в денежном выражении и 58,7% – в натуральном. Сколько платят врачам отечественные производители, неизвестно.
Выплаты врачам со стороны фармацевтических компаний в России запрещены еще с 2011 года, когда был принят Закон «Об основах охраны здоровья граждан в РФ», напоминает директор НИИ организации здравоохранения и медицинского менеджмента столичного департамента здравоохранения Давид МЕЛИК-ГУСЕЙНОВ. По его словам, сейчас, чтобы представитель фармкомпании встретился со специалистом, необходим приказ от менеджмента медицинского учреждения. Личные встречи фармпредставителя и врача практически исключены, так как это всегда проведение круглых столов. Но, признает Мелик-Гусейнов, фармкомпании имеют право взаимодействовать с врачами для подготовки совместных научных работ и исследований.
«Лично для меня это (сотрудничество с фармкомпаниями. – РБК) возможность доводить до дальних регионов технологии из центра, рассказывать об организации медпомощи пациентам», — утверждает Веселов. Затейщиков говорит, что сотрудничает с производителями лекарств из «интереса к научным работам».
Переключились на чиновников
Фармкомпании отошли от агрессивного маркетинга, который был свойственен рынку в 1990-2000-х годах, считает Давид Мелик-Гусейнов. Сейчас компании, которые производят рецептурные инновационные препараты, переключили свою активность на чиновников, принимающих решения о государственных закупках. Речь идет, например, о затратах на сбор доказательств, которые формируют позицию государственной системы в отношении лекарств, то есть фармакоэкономическое досье на препарат.
Весомый процент
Выплаты фармкомпаний российским врачам могут составлять почти 1% государственных расходов на оплату труда медицинским специалистам высшей категории, подсчитал РБК. Среднемесячная зарплата врачей-бюджетников в целом по стране составила, по данным Росстата, в 2017 году 56,4 тысяч руб., а средняя численность врачей – 566 тысяч человек. Таким образом, зарплатный фонд врачей, который брался из государственного бюджета, за весь 2017 год можно оценить примерно в 383 млрд руб.
«Размер зарплаты российских врачей здесь ни при чем, и нельзя сказать, что они вынуждены искать возможности для дополнительного заработка», – говорит специалист Национального исследовательского центра онкологии им. Н.Н. Блохина Илья ПОКАТАЕВ (получил от французской Sanofi в 2017 году 1,1 млн руб.). «В соответствии с контрактом выполняется работа, за которую и платятся гонорары», – пояснил врач.
С 16 специалистами, фигурирующими в получившемся рейтинге, оперативно связаться не удалось.
Авторы:
Д. ЛИНДЕЛЛ, С. СОБОЛЕВ, М. КОКОРЕВА, Ю. ЛЫМАРЬ, при участии А. Демидовой, И. ТКАЧЁВА, Е. ТАРАСЕНКО (rbc.ru)
Подробнее на РБК:
https://www.rbc.ru/business/05/07/2018/5b3cd8cb9a7947ab9d1841ce
[/vc_column_text]
МАРКИРОВКА ЛП НЕ ДОЛЖНА СТАТЬ БАРЬЕРОМ ДЛЯ ЕДИНОГО РЫНКА ЛЕКАРСТВ ЕАЭС
Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки (кодификации) упаковок лекарственных средств не должно стать барьером для их обращения в рамках единого рынка лекарств. Об этом сообщили в Европейской экономической комиссии.
 «Маркировка контрольно-идентификационными знаками потребует совершения производителями лекарственных препаратов определенных действий, предусмотренных законодательством Российской Федерации, но барьером такие требования стать не должны», – отметил начальник отдела координации работ в сфере обращения лекарственных средств и медицинских изделий Европейской экономической комиссии Дмитрий РОЖДЕСТВЕНСКИЙ.
«Маркировка контрольно-идентификационными знаками потребует совершения производителями лекарственных препаратов определенных действий, предусмотренных законодательством Российской Федерации, но барьером такие требования стать не должны», – отметил начальник отдела координации работ в сфере обращения лекарственных средств и медицинских изделий Европейской экономической комиссии Дмитрий РОЖДЕСТВЕНСКИЙ.
Принятый в целях обеспечения функционирования общего рынка лекарственных средств пакет документов Евразийского экономического союза включает решение Совета комиссии от 3 ноября 2016 г. №76, определяющее требования маркировки лекарственных препаратов.
Эти требования предусматривают единую маркировку для препаратов, выпускаемых в обращение на территориях государств-членов, при этом в случае наличия различающейся информации (условия отпуска и т.п.) ее указывают с использованием дополнительной этикетки (стикера) в специально отведенном поле вторичной упаковки, пояснил эксперт.
Если на вторичной упаковке предусмотрено предназначенное для специальной информации государства-члена поле, в нем допускается нанесение такой информации (например, разный статус отпуска из аптечной сети или специальная информация: «упаковка для стационаров», «по государственным программам» и др.) без использования этикетки (стикера).
Кроме того, г-н Рождественский пояснил, что прорабатывается вопрос введения системы мониторинга на территории ЕАЭС.
«В Алматы 2 февраля 2018 года подписано Соглашение о маркировке товаров средствами идентификации в Евразийском экономическом союзе, которое еще не вступило в силу, – уточнил сотрудник комиссии. – Процедурно при принятии решения о введении маркировки товаров Советом комиссии будет утвержден перечень таких товаров с указанием их кодов в соответствии с единой ТН ВЭД ЕАЭС. В нем будут определены дата введения и порядок маркировки товаров, средства идентификации, а также состав и структура информации, которая должна содержаться в средствах идентификации на основе сведений (при их наличии), содержащихся в едином реестре средств идентификации».
Вопросами маркировки в комиссии занимается Департамент таможенно-тарифного и нетарифного регулирования. Они обсуждаются с участием представителей бизнеса в экспертных группах по вопросам маркировки лекарственных препаратов, обуви и ювелирных изделий средствами идентификации.
pharmvestnik.ru
КОМПАНИЯ «GEDEON RICHTER» УДОСТОИЛАСЬ НАГРАДЫ ЗА ИННОВАЦИОННЫЙ АНТИПСИХОТИЧЕСКИЙ ПРЕПАРАТ
 Венгерский инновационный фонд (Hungarian Innovation Foundation) присудил компании «Gedeon Richter» гран-при за карипразин (Vraylar®/Reagila®), новый оригинальный венгерский препарат на мировом рынке.
Венгерский инновационный фонд (Hungarian Innovation Foundation) присудил компании «Gedeon Richter» гран-при за карипразин (Vraylar®/Reagila®), новый оригинальный венгерский препарат на мировом рынке.
Награда была вручена председателю компании «Gedeon Richter» Эрику БОГШУ (Erik Bogsch) Яношем ЛАТОРЦАИ (János Latorcai), вице-спикером Национального собрания Венгрии (Hungarian National Assembly), и Йожефом ПАЛИНКАШЕМ (József Pálinkás), председателем Национального бюро по исследованиям, развитию и инновациям (National Research, Development and Innovation Office).
Инновации всегда играли ключевую роль в стратегии развития компании «Gedeon Richter». За свою 117-летнюю историю компания вывела на рынок более 10 запатентованных лекарств, внеся значительный вклад в улучшение здоровья людей во всем мире. Инновации «Gedeon Richter» часто получали заслуженное признание.
Карипразин, удостоившийся награды за свою инновационность, представляет собой пероральный атипичный антипсихотик, разработанный венгерскими учеными компании «Gedeon Richter» и выведенный на глобальный рынок благодаря совместным усилиям компаний «Gedeon Richter» и «Allergan». В настоящее время карипразин имеет разрешение на маркетинг на более чем 70% территории глобального фармацевтического рынка.
FDA одобрило карипразин в форме капсул в сентябре 2015 г. для лечения пациентов с острыми маниакальными или смешанными эпизодами, связанными с биполярным расстройством I типа, а также для лечения шизофрении.
Европейская комиссия выдала лицензию на маркетирование карипразина в ЕС в июле 2017 г. Препарат продается в странах Европы под торговым названием Reagila® и предназначен для лечения пациентов с шизофренией. В нескольких странах ЕС в настоящее время ведутся переговоры о включении этого препарата в программу реимбурсации.
Изучение карипразина продолжается с целью оценки его эффективности по другим показаниям — у взрослых пациентов с биполярной депрессией и в качестве дополнительной терапии для лечения большого депрессивного расстройства.
Справка. Премия «Innovation Grand Prize» учреждена для признания венгерских компаний, внедряющих значимые и прибыльные инновации. Вручается ежегодно с 1993 г.
richter.hu
ПОВЫШАЮТСЯ СУММЫ ВЗНОСОВ ДЛЯ ЗАЯВИТЕЛЕЙ ЗА РЕГИСТРАЦИОННЫЕ ПРОЦЕДУРЫ EMA
 Общие взносы в Европейское агентство по лекарственным средствам (European Medicines Agency — ЕМА) для заявителей или владельцев маркетинговой лицензии, не связанные с фармаконадзором, повышаются на 1,7% с 1 апреля 2018 г.
Общие взносы в Европейское агентство по лекарственным средствам (European Medicines Agency — ЕМА) для заявителей или владельцев маркетинговой лицензии, не связанные с фармаконадзором, повышаются на 1,7% с 1 апреля 2018 г.
Ежегодно 1 апреля ЕМА пересматривает размер взносов в соответствии с уровнем инфляции в Европейском Союзе (ЕС) за предыдущий год. Нынешний рост отражает уровень инфляции за 2017 г., опубликованный статистическим управлением Европейского Союза.
Все заявки, полученные до 31 марта, будут оцениваться относительно предыдущих тарифов, и только для заявок, полученных после этой даты, тарификация проходит по новому расчету.
Так, размер взносов ЕМА на период с 1 апреля 2018 по 1 апреля 2019 г. составляет:
|
apteka.ua
ПРЕПАРАТЫ, ОЖИДАЮЩИЕ ОДОБРЕНИЯ FDA В АПРЕЛЕ 2018 ГОДА
В апреле Комиссия по контролю за качеством пищевых продуктов и медикаментов США (FDA) планирует вынести решение по нескольким важным медицинским препаратам от ряда фармацевтических компаний.
 Merck & Co. Inc. (NYSE: MRK) запросила одобрение FDA для расширенного использования своего препарата для борьбы с раком Keytruda. Решение ожидается 3 апреля. В 2017 г. продажи препарата составили $3,8 млрд.
Merck & Co. Inc. (NYSE: MRK) запросила одобрение FDA для расширенного использования своего препарата для борьбы с раком Keytruda. Решение ожидается 3 апреля. В 2017 г. продажи препарата составили $3,8 млрд.
6 апреля Clovis Oncology Inc. (NASDAQ: CLVS) получит решение по поводу нового использования Rubraca. Компания ждет одобрения Rubraca в качестве поддерживающего лечения у женщин с рецидивирующим раком яичников.
Rigel Pharmaceuticals Inc. (NASDAQ: RIGL) узнает, будет ли одобрен его пероральный препарат Tavalisse, предложенный для лечения взрослых пациентов с хронической иммунной тромбоцитопенией, 17 апреля. Если это произойдет, аналитики ожидают, что пиковые продажи Tavalisse составят $360 млн.
19 апреля группа независимых экспертов, созванная FDA, планирует рассмотреть заявку GW Pharmaceuticals plc. (NASDAQ: GWPH) на коммерциализацию Epidiolex, созданного для лечения приступов, связанных с синдромом Леннокса-Гасто или синдромом Дравета. Окончательное решение FDA относительно Epidiolex ожидается к 27 июня. Если препарат будет одобрен, аналитики ожидают, что Epidiolex принесет более $1 млрд в год пиковых продаж.
Группа экспертов FDA планирует рассмотреть заявку препарата Baricitinib, разработанного для лечения пациентов с ревматоидным артритом средней тяжести, 23 апреля. Baricitinib совместно разрабатывается Eli Lilly and Co. (NYSE: LLY) и Incyte Corp. (NASDAQ: INCY).
Mallinckrodt Public Limited Co (NYSE: MNK) узнает решение чиновников относительно расширенного использования своего лекарства Amitiza 28 апреля. Мировые продажи препарата в прошлом году составили $456 млн.
ffin.ru
ФАКТОРЫ, КОТОРЫЕ ИЗМЕНЯТ ГЛОБАЛЬНОЕ ЗДРАВООХРАНЕНИЕ В БЛИЖАЙШИЕ 5 ЛЕТ
Институтом исследований человеческих данных IQVIA опубликован доклад, отражающий основные тенденции, которые будут определять развитие глобального здравоохранения в ближайшие 5 лет. Согласно отчету, глобальное здравоохранение стоит на пороге ключевых поворотных моментов.
 При этом изменения, которые произойдут в 2018 году, будут определять перспективы на ближайшие пять лет и последующие годы. Среди них: разработка принципиально новых лекарственных средств; появление новых технологий и способов сохранения и улучшения здоровья, изменение подходов к расчету стоимости технологий здравоохранения и социальной ценности лекарств.
При этом изменения, которые произойдут в 2018 году, будут определять перспективы на ближайшие пять лет и последующие годы. Среди них: разработка принципиально новых лекарственных средств; появление новых технологий и способов сохранения и улучшения здоровья, изменение подходов к расчету стоимости технологий здравоохранения и социальной ценности лекарств.
- Более активное использование доказательств реального мира (Real-World Evidence – RWE) регуляторными органами, плательщиками, исследовательскими центрами и фармацевтическими компаниям.
- Введение в клиническую практику биотерапевтических технологий нового поколения.
За последние десятилетия значительно возросло использование компьютеров и других электронных устройств для сбора и хранения данных, связанных со здоровьем. Это так называемые данные реального мира (Real World Data – RWD), то есть сведения, касающиеся состояния здоровья пациента и/или предоставления медицинской помощи, регулярно собираемые из различных источников (электронные медицинские записи, данные от страховых компаний о возмещении расходов на лечение, сведения о фармаконадзоре, аптечные данные о рецептурных заказах, реестры продуктов и болезней, истории болезни, амбулаторные карты, устройства мониторинга здоровья).
По мере того, как большие данные (Big Data), собранные в условиях реальной клинической практики, становятся более объемными и надежными, они все чаще начинают использоваться в системе здравоохранения в качестве доказательств реального мира (Real-World Evidence – RWE) при оценке эффективности и безопасности лекарств и медицинских технологий, применяемых вне клинических испытаний, то есть в реальной практике.
Данные реального мира уже широко используются держателями бюджетов здравоохранения для принятия решений о возмещении расходов на лекарственные средства. Сравнительно недавно их стали применять спонсоры клинических исследований и регуляторные органы. В первом случае они позволяют лучше, проектируя, проводить клинические исследования, формулировать исследовательские гипотезы и осуществлять набор пациентов, а во втором – принимать решения в отношении безопасности и эффективности продукта после его выхода на рынок. Важно, что использование данных реального мира может способствовать ускорению и удешевлению процессов разработки и одобрения лекарств.
Выпуск первых критериев использования данных реального мира в дополнение к данным, полученным из обычных рандомизированных контролируемых исследований, при одобрении лекарств запланирован FDA на декабрь 2018 года, а выход окончательного руководства – на декабрь 21 года. В результате производители лекарств получат понимание, какие доказательства, основанные на RWE, будет принимать FDA при одобрении лекарств.
Использование RWE позволит сократить расходы производителей на исследования, тем самым ускорит процесс одобрения новых лекарств, комбинированных схем лечения рака, применения уже присутствующих на рынке препаратов по новым показаниям и т.д.
- Введение в клиническую практику биотерапевтических технологий нового поколения.
В медицинскую практику постепенно приходят технологии клеточной и генной терапии, а также регенеративные лекарства, которые при одобрении получают статус «прорывных» методов или препаратов. Их свойства и новизна меняют взгляд на привычное определение того, что представляет собой лекарство как клинически, так и с точки зрения ожиданий результатов, продолжительности лечения и затрат. Некоторые из них подразумевают индивидуальную генную инженерию, давая возможность полного излечения в результате одноразового применения.
В конце прошлого и начале текущего года впервые в мировой истории от FDA получили одобрение две технологии генной терапии CAR-T. Согласно прогнозам IQVIA, в 2018 году будет одобрено 5-8 биотерапевтических методов/препаратов нового поколения. На этапе III фазы клинических исследований находится еще 40-45 новых биологически активных веществ (рисунок 1). Они появятся на рынке в течение следующих пяти лет.
Биотерапевтические методы нового поколения
| Генная терапия | ||
| Адено-ассоциированная вирусная генная терапия | Генетическая терапия | Генная терапия
на основе плазмид |
| Аденовирусная генная терапия | Генетически спроектированная аутологичная клеточная терапия | Ретровирусная генная терапия |
| ДНК-вакцины | Генетически спроектированная аутологичная клеточная вакцина | Целенаправленный ремонт генов |
| Регуляция экспрессии генов | Генная терапия с использованием в качестве вектора герпес-вируса | Использование генов супрессоров опухолей |
| Генная технология | Генная терапия с использованием в качестве векторов липидных наночастиц | Генная терапия с использованием вирусных векторов |
| Система переноса генов | Невирусная генная терапия | |
| Клеточная терапия |
| Клеточная инженерия |
| Клеточная трансплантация |
| Соматическая клеточная терапия |
| Терапия стволовыми клетками |
| Трансплантация стволовых клеток |
| Тканевая инженерия |
| Регенерация тканей |
| Тканевая терапия |
| Ксеногенная, или межвидовая, трансплантация |
Однако стоимость такого лечения чрезвычайно высока по сравнению с традиционными, малыми терапевтическими молекулами. К примеру, за генную терапию В-клеточного острого лимфобластного лейкоза Kymriah (tisagenlecleucel) компанией Novartis Pharmaceuticals была установлена цена в размере $475 000, а гомологичная ей терапия Yescarta (axicabtagene ciloleucel) была оценена Gilead Science в $373 000. Высокая стоимость и разница в ценах CAR-T-терапии от разных компаний разожгла новую дискуссию по поводу роста цен на лекарства, отпускаемые по рецепту.
В ответ на это компания Novartis заявила, что будет взимать плату за терапию Kymriah только в том случае, если пациенты ответят на лечение в течение месяца от начала терапии. Между тем Gilead Science не последовала этому примеру.
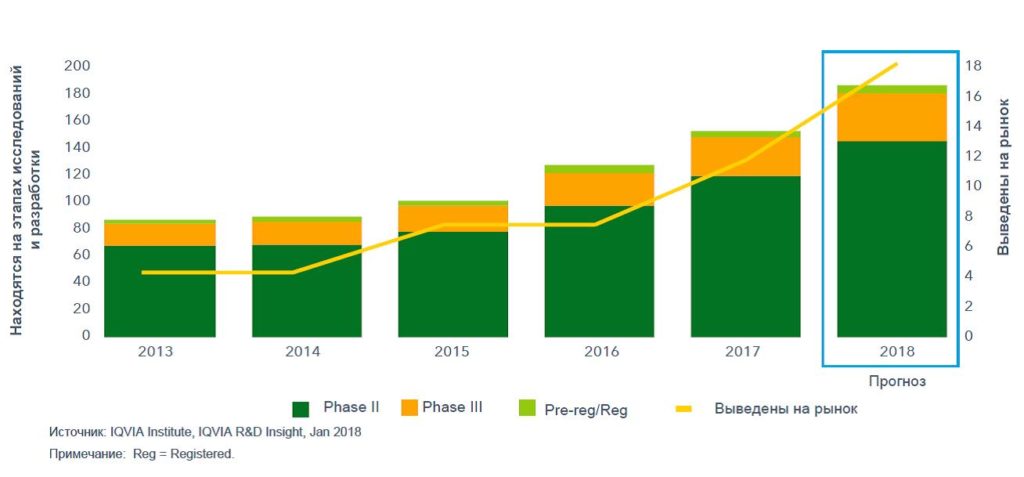 Рисунок 1 – Количество биотерапевтических методов/препаратов следующего поколения, уже присутствующих на рынке и находящихся на поздних стадиях исследований
Рисунок 1 – Количество биотерапевтических методов/препаратов следующего поколения, уже присутствующих на рынке и находящихся на поздних стадиях исследований
Многие из этих революционных подходов слишком новы, чтобы иметь доказанные результаты в плане отдаленной эффективности и безопасности. Сочетание такого рода неопределенности с высокими издержками повлияет на то, как эти лекарства будут оплачиваться и использоваться.
По мере распространения инновационных видов лечения давление на бюджеты систем здравоохранения будет возрастать. Поэтому плательщикам предстоит создать новую схему их оплаты и возмещения, чтобы максимизировать доступ к этим клиническим достижениям.
- Включение цифровых приложений в клинические руководства
Использование инструментов Digital Health, в том числе мобильных приложений для здоровья и носимых медицинских устройств, открывает огромные перспективы в улучшении здоровья человека. Как и в случае с другими новыми технологиями здравоохранения, для их использования в клинической практике требуются доказательства эффективности. И таких доказательств появляется все больше: с 2007 года по август 2017 года опубликовано 571 исследование. В 2018 году, согласно прогнозам IQVIA, будут завершены и опубликованы еще примерно 340 исследований, а в ближайшие 5 лет их количество возрастет до 3500 (рисунок 2). На сегодняшний день уже получены убедительные доказательства эффективности инструментов цифрового здравоохранения в контроле сахарного диабета, депрессии и тревожных расстройств. Процесс создания убедительных доказательств в поддержку цифровых инструментов и вмешательств будет продолжаться, что поспособствует их включению в практические рекомендации.
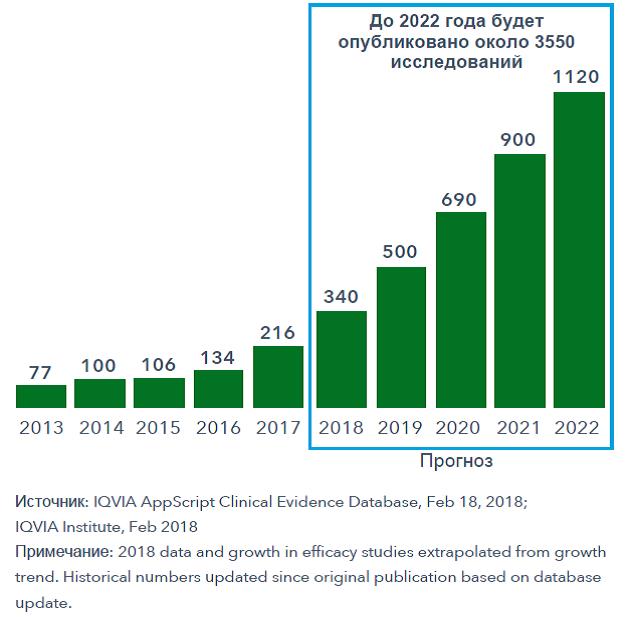
Рисунок 2 – Количество опубликованных исследований эффективности использования
цифровых медицинских технологий
Появление хорошо разработанных приложений и мобильных устройств позволит улучшить результаты лечения, иногда при почти нулевых дополнительных затратах. Они будут охватывать широкий спектр заболеваний, войдут в клинические руководства и протоколы, а их стоимость будет возмещаться плательщиками. Однако предстоит урегулировать вопросы конфиденциальности, безопасности и интеграции технологий в рабочий процесс.
- Расширение использования телемедицины
Благодаря более широкому распространению высокоскоростного интернета, использованию специальных мобильных приложений, а также носимых медицинских устройств появилась возможность обслуживания пациентов посредством телефонных и интернет консультаций (рисунок 3). Сторонники телемедицины утверждают, что во многих случаях очные врачебные приемы могут проводиться удаленно. Обходится такое дистанционное консультирование значительно дешевле, чем традиционные визиты к врачу, что очень важно, учитывая растущие затраты на здравоохранение.
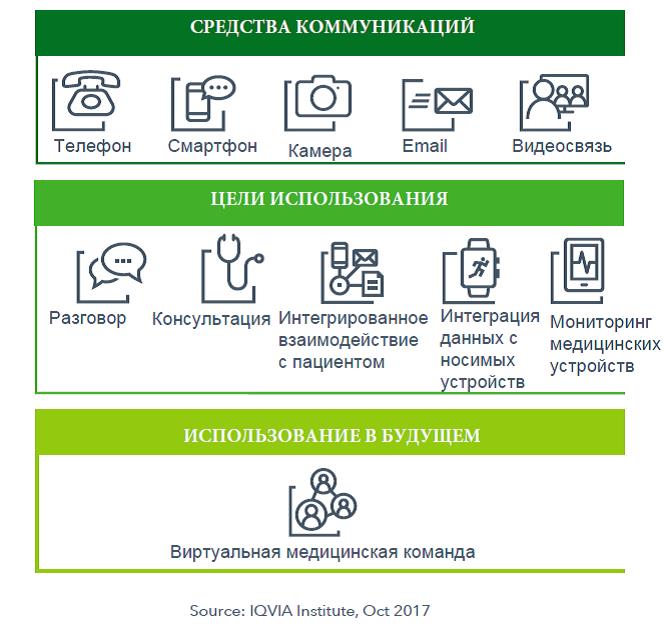
Рисунок 3 – Средства коммуникаций и цели их использования в телемедицине
Согласно прогнозам аналитиков, в 2018 году в США количество телеконсультаций увеличится на 15-40%, достигнув 35-42 млн. Если данная тенденция сохранится, к 2022 году 7,5% врачебных приемов будут осуществляться посредством телеконсультирования.
Следует отметить, что в 2018 году крупные работодатели в США стали применять финансовые стимулы к своим бенефициарам за использование услуг телемедицины. Ожидается, что удобство и экономия затрат приведут к расширению использования телемедицины. В течение следующих пяти лет каждый пациент, вероятно, столкнется с какой-либо формой взаимодействия посредством телекоммуникаций.
Телеконсультации особенно актуальны при ненадлежащем использовании первичной медико-санитарной помощи, а также в тех случаях, когда пациенты злоупотребляют услугами неотложной и скорой помощи. Некоторые страны уже достигли определенных успехов в использовании телекоммуникаций для обслуживания таких пациентов, что позволило им значительно снизить издержки.
- Снижение расходов на оригинальные брендированные лекарства на развитых рынках.
С 2013 по 2017 годы расходы на оригинальные брендированные лекарства на развитых рынках увеличились с $326 до $395. Однако в 2018 году, согласно прогнозам IQVIA, они сократятся на 1-3%, то есть до $391 млрд, и в последующие 5 лет останутся практически неизменными. Производители будут продолжать разрабатывать, затем выводить на рынок новые молекулы, но их будет несколько меньше, чем препаратов, которые потеряют эксклюзивность вследствие окончания срока патентной защиты. Кроме того, свою роль сыграют плательщики и держатели бюджетов, которые будут контролировать цены при обеспечении доступа к новым лекарствам.
- Рост расходов на развитых рынках будут стимулировать специализированные лекарства.
В последнее десятилетие в сегменте новых лекарственных средств наблюдается устойчивый сдвиг в сторону специализированных фармацевтических препаратов (рисунок 4). К ним относятся лекарственные средства для лечения хронических, сложных или редких заболеваний (в том числе онкологических, аутоиммунных заболеваний, гепатита С и других), а также требующие особого администрирования поставщиком медицинских услуг, особых условий при дистрибуции, тщательного фармаконадзора и принятия прочих мер.
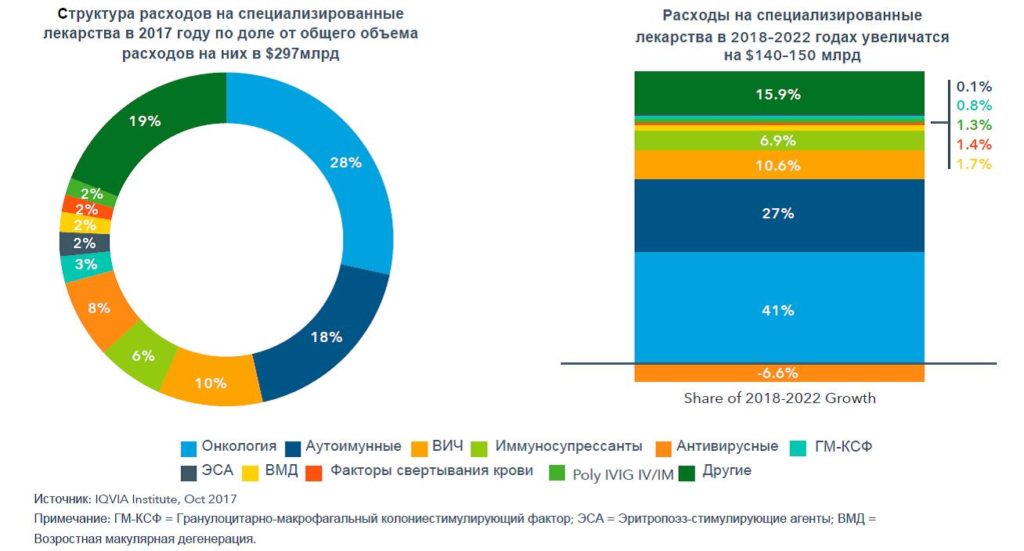
Рисунок 4 – Расходы на специализированные лекарственные средства и рост на развитых рынках
Специализированные продукты будут стимулировать рост расходов на медицину. Их доля в структуре расходов на лекарственные средства на десяти крупнейших рынках будет увеличиваться. Так, в 2017 году она составляла 39% ($297 млрд), в 2018 году, по прогнозам IQVIA, она возрастет до 41% ($318 млрд), а к 2022 году, несмотря на сдерживание цен со стороны регуляторов и плательщиков, достигнет 48%. Отчасти это связано с тем, что у таких препаратов обычно очень мало прямых конкурентов.
- Конкуренция со стороны биосимиляров будет усиливаться.
В настоящее время конкуренция со стороны биосимиляров на развитых рынках невелика. В 2017 году с ней столкнулось лишь 7 из 196 оригинальных биологических молекул с объемом продаж в $26 млрд. Однако, согласно прогнозам, пик окончания сроков патентной защиты на оригинальные биопрепараты на развитых рынках и появления биосимиляров придется на 2019-2022 годы. Они составят конкуренцию оригинальным биопрепаратам с объемом продаж в $52 млрд на развитых рынках, а к 2027 году 77% текущих расходов на биопрепараты будут подвергаться определенной форме конкуренции (рисунок 5).
Преимущества увеличения количества биосимиляров на рынке для потребителя очевидны. Они способствуют экономии затрат, расширяя тем самым доступ к биологической терапии. Однако только время покажет, какая экономия будет сгенерирована биосимилярами.
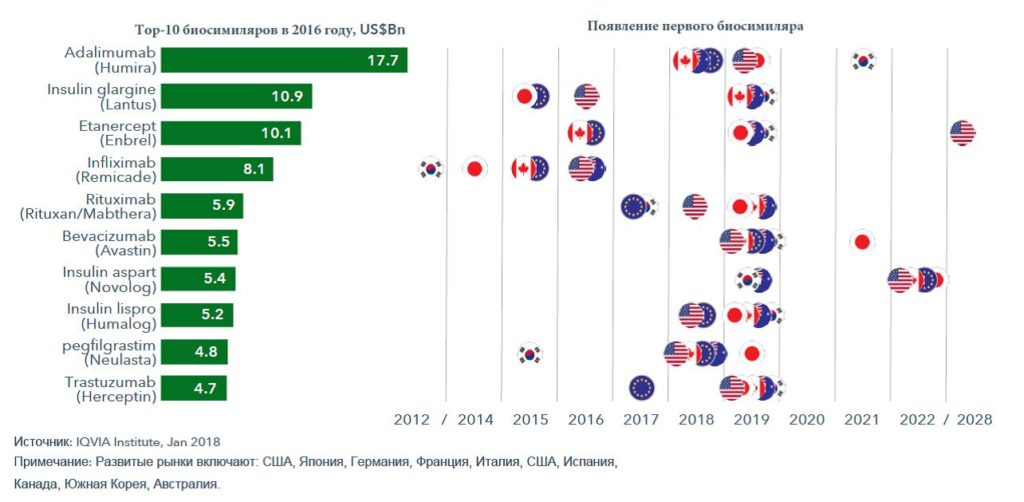
Рисунок 5 –Тор-10 оригинальных биопрепаратов по объему продаж в 2016 году на развитых рынках и появление первых биоподобных конкурентов
Среди факторов, которые окажут влияние на глобальное здравоохранение, аналитики IQVIA также называют:
-замедление темпов роста фармацевтических рынков стран, отнесенных к кластеру развивающихся рынков (Pharmerging Markets), некоторое сокращение показателя расходов на лекарства на душу населения в США;
-сдерживание затрат на лечение дорогостоящими лекарствами путем более активного использования схемы оплаты по результату терапии, когда держатели бюджетов платят меньше, если препарат показал себя не столь эффективным, чем было продемонстрировано в клинических исследованиях.
Полная версия отчета, включая подробное описание методологии, доступна на сайте www.IQVIAInstitute.org.
Ольга БАИМБЕТОВА,
EMA ОЦЕНИВАЕТ ГОТОВНОСТЬ ФАРМАЦЕВТИЧЕСКИХ КОМПАНИЙ К BREXIT

Европейское агентство по лекарственным средствам (European Medicines Agency – EMA) начинает опрос фармацевтических компаний об их готовности к Brexit для выявления проблем в отношении поставок лекарств, которые могут повлиять на здоровье людей или животных.
EMA консультирует владельцев маркетинговых лицензий на лекарства, одобренные по централизованной процедуре, которые локализуются в Великобритании или проводят в этой стране определенные виды деятельности: контроль качества, выпуск партий и/или имеют производственные участки, квалифицированных лиц для фармаконадзора (Qualified Persons for Pharmacovigilance — QPPV), мастер-файл системы фармаконадзора владельца торговой лицензии (Pharmacovigilance system master file – PSMF), относительно своих планов по поводу переезда, изменений в процедуре выдачи разрешения на маркетинг в контексте выхода Великобритании из Европейского Союза (ЕС).
Цель этого опроса двоякая. Во-первых, идентифицировать компании, которые нуждаются в согласованных действиях по решению проблем с поставками лекарственных средств из-за Brexit, а во-вторых, помочь ЕМА и Европейской комиссии планировать деятельность на других территориях. Информация из опроса также будет использоваться для информирования о следующих шагах готовности к Brexit EMA, Европейской комиссии, Европейской регуляторной сети лекарственных средств.
Опрос направляется непосредственно владельцам маретинговых лицензий на лекарства, одобренные по централизованной процедуре, которые локализуются в Великобритании или проводят в этой стране определенные виды деятельности. Крайний срок заполнения анкеты – 9 февраля 2018 г.
Опрос также послужит стимулом для тех компаний, которые еще не предприняли действий по планированию мер, необходимых для того, чтобы их продукты, одобренные по централизованной процедуре, остались на рынке ЕС, а риски, связанные с отсутствием поставок лекарств, были сведены к минимуму после Brexit.
Выводы и рекомендации из проведенного опроса будут переданы Европейской комиссии и представлены Правлению EMA. Краткое резюме общих результатов опроса будет опубликовано на веб-сайте EMA.
ema.europa.eu
КАК ПРОРЕКЛАМИРОВАТЬ БРЭНД В СОЦИАЛЬНЫХ СЕТЯХ?
 Фармацевтические компании часто сотрудничают со знаменитостями для продвижения брэндов. Тем не менее есть более эффективный инструмент влияния на потребителей в этом плане – микролидеры мнений в социальных сетях.
Фармацевтические компании часто сотрудничают со знаменитостями для продвижения брэндов. Тем не менее есть более эффективный инструмент влияния на потребителей в этом плане – микролидеры мнений в социальных сетях.
Знаменитости в традиционном смысле слова, например, звезды телевидения, постепенно уступают место микролидерам мнений в плане влияния на вкусы потребителей. Микролидеры мнений в социальных сетях имеют широкую аудиторию и пользуются доверием у своих подписчиков.
Новые исследования маркетингового агентства #paid и компании Nielsen показали, что люди доверяют микролидерам мнений в цифровых каналах больше, чем любому другому рекламному контенту. Микролидеры мнений в социальных сетях произвели на 60% больший сдвиг в восприятии брэндов, что указывает на то, что им доверяют больше, чем знаменитостям в традиционном смысле этого слова, когда дело доходит до рекламы брэндов.
Традиционные рекламные каналы широко используются для продвижения фармацевтических брэндов, однако социальные сети, вероятно, лучше работают, когда речь заходит о таких показателями, как оценка брэнда и намерение покупки.
Идея состоит в том, что микролидеры мнений в социальных сетях, как правило, популярные среди молодежи и цифровых пользователей, могут рекламировать продукты для здоровья и лечения заболеваний посредством рассказа своих историй с упоминанием того или иного продукта. Естественно, с указанием того, что такой пост является рекламным или проспонсированным.
Как правило, для микролидеров мнений в социальных сетях важно доказать ценность продукта, поскольку они не работают с любыми торговыми марками и к рекламе подходят взвешенно. То есть они должны выбрать для себя брэнд, который будут рекламировать, и поверить в него.
apteka.ua
(по материалам www.fiercepharma.com)
СЛИЯНИЯ И ПОГЛАЩЕНИЯ В СФЕРЕ ФАРМАЦИИ И БИОТЕХНОЛОГИЙ:
ИТОГИ 2017 ГОДА

M&A-активность фармацевтических и биотехнологических компаний несколько стихла по сравнению с предыдущими годами. В 2017 г. объявили о заключении 101 M&A-сделки. В 2016 г. таковых было 130, а в 2015 г. – 166. При этом количество сделок, превышающих $1 млрд США, в 2017 г. составило 15, в 2016 г. — 23, а в 2015 г. – 30.
Крупнейшей сделкой года является соглашение между компаниями двух разных сегментов сферы здравоохранения (вертикальное слияние) — аптечной сетью CVS Health (США) и страховой компанией Aetna (США). Согласно соглашению CVS Health приобретает все выпущенные акции Aetna по $207 за акцию, что составит $69 млрд. Завершение этой сделки планируется на вторую половину 2018 года
Еще одна крупная сделка — приобретение концерном Johnson & Johnson (США) биотехнологической компании Actelion (Швейцария) за $30 млрд (по $280 за акцию). По условиям сделки на основе подразделения исследований и разработок Actelion образуется новая компания, которая будет называться R&D NewCo.
Gilead Sciences (США) в этом году приобрела 2 биотехнологические компании, специализирующиеся на разработке продуктов для клеточной терапии. В $11,9 млрд оценивается сделка с Kite Pharma. Вторая сделка менее крупная. Соглашение по приобретению Cell Design Labs включает авансовый платеж в размере $175 млн и дополнительные выплаты – до $322 млн.
Среди других крупных сделок, объявленных в 2017 году, стоит выделить приобретение крупным производителем лабораторного оборудования Thermo Fisher Scientific (США) контрактной организации Patheon (Нидерланды) за $7,2 млрд. Takeda Pharmaceutical (Япония) подписала соглашение о приобретении производителя противоопухолевых препаратов Ariad Pharmaceuticals (США) за $5,2 млрд, а инвестиционный фонд Pamplona Capital Management приобрел контрактную исследовательскую организацию Parexel за $5 млрд.
apteka.ua
(по материалам www.thepharmaletter.com)
FDA ПРИСВОИЛА СТАТУС ПРОРЫВНОЙ ТЕРАПИИ НОВОЙ КОМБИНИРОВАННОЙ СХЕМЕ ЛЕЧЕНИЯ РАКА ПОЧКИ, КОТОРУЮ СОВМЕСТНО РАЗРАБАТЫВАЮТ КОМПАНИИ MERCK & CO И EISAI
Как сообщает ФармВестник.ру, согласно новой схеме при лечении пациентов с распространенным или метастатическим почечно-клеточным раком применяется комбинация ингибитора множественных рецепторов тирозинкиназы Lenvima (lenvatinib) и анти-PD-1 моноклонального антитела Keytruda (pembrolizumab).
Клинические исследования второй фазы показали достижение подтвержденной частоты объективного ответа 63% к 24-й неделе и частоту контроля заболевания в 96%.
Получение статуса «прорывной» терапии даст компаниям право на приоритет в рассмотрении их заявки на одобрение со стороны регулятора.
riaami.ru
В ЕВРОПЕ ОДОБРЕН ПРЕПАРАТ ОКРЕВУС (ОКРЕЛИЗУМАБ) КОМПАНИИ ROCHE ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА
Препарат Окревус/Ocrevus (окрелизумаб/ocrelizumab) компании Roche получил одобрение в Европе для использования у взрослых пациентов с рецидивирующим рассеянным склерозом и первично-прогрессирующим рассеянным склерозом.
Окрелизумаб представляет собой моноклональное антитело, специфичное к CD20 позитивным В-клеткам иммунной системы, которые считаются ключевым фактором повреждения миелина и аксонов.
По данным компании, использование препарата Окревус способствовало значительному сокращению годового показателя рецидивов на 46,4% за 96 недель по сравнению с интерфероном бета-1a у пациентов с рецидивирующим рассеянным склерозом. У пациентов с первично-прогрессирующим рассеянным склерозом применение окрелизумаба привело к 24-процентному снижению риска прогрессирования инвалидности по сравнению с плацебо.
Препарат Окревус (окрелизумаб) был одобрен в США в марте прошлого года, в России – в ноябре 2017 года.
clinical-pharmacy.ru
АМЕРИКАНСКАЯ АПТЕЧНАЯ СЕТЬ CVS PHARMACY БУДЕТ ПРЕДУПРЕЖДАТЬ КЛИЕНТОВ О РЕТУШИ В РЕКЛАМЕ КОСМЕТИКИ
Аптека намерена добиваться того, чтобы косметические бренды прекратили использовать фотошоп в рекламе.

Предлагается маркировать плакаты специальным знаком CVS Beauty Mark, который будет свидетельствовать о том, что изображенная в рекламе модель красива настолько, что это недостижимо в реальной жизни.
riaami.ru
TEVA ПОДНЯЛА ЦЕНЫ НА 20 СВОИХ ПРЕПАРАТОВ
Израильская компания Teva Pharmaceutical Industries Ltd повысила цену на 20 лекарственных препаратов, как оригинальных, так и дженериков, утверждает аналитик по вопросам здравоохранения в UBS Investment Bank Марк ГУДМАН. По его словам, в этом году в США фармкомпании повысили цены почти на 500 наименований лекарств.

Teva не стала поднимать цену на свой флагманский препарат для лечения рассеянного склероза «Копаксон» (глатирамера ацетат), который и так сталкивается с конкуренцией Mylan, отметил Гудман. В январе прошлого года Teva повысила цену на «Копаксон» на 7,9%. Недавно Конгресс США представил данные, в соответствии с которыми цена на этот препарат с момента его запуска в 1996 году выросла на 1002%, сообщает израильская бизнес-газета Globes.
По данным издания, повышение цен компании колебалось в пределах от 2,3% до 9,4%. Цена на препарат Amrix (циклобензаприн гидрохлорид) для лечения мышечных спазмов повысилась на 9,4%. Цена на терапию Teva’s Parkinson Azilect (разагилин) повысилась на 3%, и это при том, что препарат уже подорожал на 9,9% в 2016 году и на 9,4% в 2017 году. Подорожали и лекарства для лечения респираторных заболеваний: Qnasl – на 8%, Qvar – на 9% (оба – беклометазона дипропионат-глюкокортикоид), AirDuo RespiClick – на 8%. Препараты химиотерапии: Treanda (бендамустин) подорожал на 6%, а Synribo (оmacetaxine) – на 4,5%.
riaami.ru
FDA ОДОБРИЛО НОВЫЙ ПРОТИВОДИАБЕТИЧЕСКИЙ ПРЕПАРАТ
FDA одобрило препарат эртуглифлозин (ertugliflozin) фармацевтических компаний MSD и Pfizer для лечения сахарного диабета второго типа. Лекарственный препарат представляет собой ингибитор SGLT-2 и является прямым конкурентом дапаглифлозина (AstraZeneca), канаглифлозина (Johnson & Johnson и Eli Lilly) и эмпаглифлозина (Boehringer Ingelheim).

Данное одобрение позволяет использовать лекарственное средство в комбинации с ситаглиптином или метформином. Действие эртуглифлозина направлено на выведение из организма пациента избытка глюкозы с мочой, тем самым сокращается уровень глюкозы в крови.
Основой для одобрения препарата стали результаты клинических исследований, согласно которым спустя 26 недель терапии эртуглифлозином и метформином уровень гликированного гемоглобина A1с снизился на 0,7% среди тех, кто получал эртуглифлозин в дозировке 5 мг, и на 0,9% среди тех, кто принимал 15 мг. При этом в группе плацебо изменений зафиксировано не было. В группах пациентов, получавших эртуглифлозин и ситаглиптин, эти показатели были равны 1,6% и 1,7% соответственно, в группе плацебо – 0,4%. В планах компаний вывести препарат на рынок уже в начале 2018 года.
clinical-pharmacy.ru
ДЛЯ ЗДРАВООХРАНЕНИЯ США 2016 ГОД
СТАЛ ГОДОМ ДЖЕНЕРИКОВ
Фармацевтические компании США являются лидерами по числу ежегодно регистрируемых в этой стране новых лекарственных препаратов. С другой стороны, с каждым годом в США растет и количество разрешенных к применению препаратов-дженериков, что способствует значительному удешевлению лечения.
Как сообщается в заявлении Кэтлин УЛЬ (Kathleen Uhl), которая занимает должность главы департамента генерических препаратов в FDA (Управление по контролю качества пищевых продуктов и лекарственных препаратов США), 2016 год стал рекордным для ее ведомства по количеству зарегистрированных препаратов-дженериков.
В прошлом году FDA разрешило к применению на территории США более 800 дженериков, многие из которых являются дженериками первого поколения, то есть химическими копиями оригинальных лекарственных средств, у которых раньше не было дженериков.
Таким образом, было превзойдено достижение 2015 года, в течение которого в США было зарегистрировано 726 генерических препаратов.
Как заявляет Кэтлин Уль, широкое применение дженериков позволило американской системе здравоохранения в течение последних 10 лет сэкономить почти $1,68 триллиона.
Регистрация дженериков, производимых разными компаниями, но являющихся лекарственными препаратами, идентичными по составу и медицинским показаниям, способствует здоровой конкуренции на рынке и, главное, снижению цен. Это облегчает доступ конечному потребителю к таким лекарственным средствам.
Значительному улучшению работы FDA в этом направлении способствовало подписание в июле 2012 года тогдашним президентом США Бараком ОБАМОЙ специального закона о деятельности FDA в новой редакции (Food and Drug Administration Safety and Innovation Act).
medstrana.com
ОРГАНИЗОВАННАЯ СДАЧА ПРОСРОЧЕННЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В ОБЩЕНАЦИОНАЛЬНОМ МАСШТАБЕ – ПОЛЕЗНЫЙ ЗАРУБЕЖНЫЙ ОПЫТ
 Лекарства с истекшим сроком годности представляют огромную потенциальную опасность, между тем практически в любой стране в каждом доме можно обнаружить не одну упаковку просроченных препаратов. В США пытаются решить эту проблему с помощью специального ежегодного Дня сдачи просроченных лекарств, который организованно проходит по всей стране.
Лекарства с истекшим сроком годности представляют огромную потенциальную опасность, между тем практически в любой стране в каждом доме можно обнаружить не одну упаковку просроченных препаратов. В США пытаются решить эту проблему с помощью специального ежегодного Дня сдачи просроченных лекарств, который организованно проходит по всей стране.
В этом году День сдачи лекарственных препаратов с истекшим сроком годности (Take Back Day) прошел в США 29 апреля, в 13-й раз. В канун важного события в национальных и местных СМИ проводится кампания по пропаганде необходимости избавления от просроченных лекарств, а также еще пригодных сильнодействующих рецептурных лекарств, в том числе содержащих опиоидные наркотики, которые по тем или иным причинам стали ненужными.
О том, какое значение власти страны придают этому мероприятию, свидетельствует тот факт, что каждый год День сдачи просроченных лекарств проходит под эгидой Управления по борьбе с наркотиками (U.S. Drug Enforcement Administration – DEA).
29 апреля по всей стране открывается около 5 500 пунктов приема лекарств, организованных DEA. Еще несколько тысяч пунктов открываются в местных управлениях полиции.
Процедура избавления от просроченных и ненужных препаратов является предельно простой и абсолютно анонимной. В минувшем 2016 году в ходе Дня сдачи просроченных лекарств жители США избавились от 447 тонн ненужных и опасных препаратов, а всего за прошедшие 12 лет в такие дни было сдано почти 3 200 тонн лекарств.
Благодаря этому мероприятию можно уменьшить число случайных бытовых отравлений медицинскими препаратами, а также случаев использования сильнодействующих опиоидных болеутоляющих с целью получения наркотического опьянения.
medstrana.com
СОЗДАН ЕДИНЫЙ РЕЕСТР СВИДЕТЕЛЬСТВ
О ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ ТОВАРОВ ЕАЭС
На сайте ЕЭК появился раздел, где размещен Единый реестр свидетельств о государственной регистрации продукции (товаров) ЕАЭС, сформированный на основании Национальных реестров Сторон.
В числе продукции, подлежащей государственной регистрации, числятся некоторые товары аптечного ассортимента, в том числе:
- пищевая продукция для детского питания;
- пищевая продукция для диетического лечебного и диетического профилактического питания;
- минеральная вода;
- пищевая продукция для питания спортсменов, беременных и кормящих женщин; биологически активные добавки;
- предметы личной гигиены для детей и взрослых;
- предметы детского обихода до трех лет: посуда и изделия, используемые для питания детей, предметы по гигиеническому уходу за ребенком;
- средства и изделия гигиены полости рта;
- средства дезинфекции, дезинсекции и дератизации.
Без наличия оформленного свидетельства о государственной регистрации на товары, для которых процедура государственной регистрации является обязательной, невозможно осуществлять законное распространение данного продукта или изделия на территории Евразийского экономического союза.
Свидетельство является действительным с момента его выдачи до прекращения поставок продукции на территорию ЕАЭС и (или) изготовления продукции на территории ЕАЭС.
internist.ru
В КАЗАХСТАНЕ НЕ ХВАТАЕТ КЛИНИЧЕСКИХ ФАРМАКОЛОГОВ
 В Казахстане не хватает около 900 клинических фармакологов. Об этом сообщил секретарь комитета Мажилиса по социально-культурному развитию, руководитель специальной временной комиссии по подготовке парламентских слушаний Бейбит МАМРАЕВ на брифинге Службы центральных коммуникаций.
В Казахстане не хватает около 900 клинических фармакологов. Об этом сообщил секретарь комитета Мажилиса по социально-культурному развитию, руководитель специальной временной комиссии по подготовке парламентских слушаний Бейбит МАМРАЕВ на брифинге Службы центральных коммуникаций.
«По данным, которыми я владею, у нас сегодня работают порядка 200 фармакологов. И что интересно, из них только пять процентов – дипломированные, изначально получившие фармакологическое образование. Видимо, остальная часть где-то в другой сфере определяется. Это раз. Второе, получается, если пять процентов работают, то остальная часть этого количества – люди, прошедшие через систему стажировок, повышения квалификации. То есть, получившие сертификат. В целом, у меня нет оснований сомневаться в их компетентности, но налицо их нехватка. Не хватает фармакологов», – сказал Бейбит Мамраев.
По его словам, в клиниках должны работать грамотные, компетентные фармакологи, которые обеспечат хорошую госпитальную фармацию и помогут результативно лечить больных, рационально использовать лекарственные средства.
Мажилисмен также сообщил, что в рамках подготовки к запланированным на 12 мая парламентским слушаниям по вопросам лекарственного обеспечения и развития фармацевтической отрасли сделан ряд депутатских запросов, в том числе по подготовке клинических фармакологов.
От редакции: О том, кто и когда начнет подготовку этих нужных отечественному здравоохранению специалистов, читайте в статье наших авторов Г. УМУРЗАХОВОЙ, кандидата фармацевтических наук, профессора А. ШОПАБАЕВОЙ, доктора фармацевтических наук, профессора У. ДАТХАЕВА «Обоснование внедрения специальностей «Клиническая фармация» И «Управление качеством в фармации» в номенклатуру фармацевтических специальностей РК» в апрельском номере журнала «Фармация Казахстана».
Мейрамбек БАЙГАРИН,
inform.kz
НАЧИНАЕТ РАБОТУ ЕДИНЫЙ РЫНОК ЛЕКАРСТВ
И МЕДИЦИНСКИХ ИЗДЕЛИЙ ЕАЭС
 Официально рынок стартовал с 6 мая 2017 года. Однако пресс-служба ЕЭК уточнила, что функционировать он будет пока что лишь формально.
Официально рынок стартовал с 6 мая 2017 года. Однако пресс-служба ЕЭК уточнила, что функционировать он будет пока что лишь формально.
С мая текущего года вступает в силу пакет из двадцати шести документов, обеспечивающий работу единого рынка лекарств и медицинских изделий в странах ЕАЭС. Это стало известно из сообщения пресс-службы Евразийской экономической комиссии. По словам министра ЕЭК Валерия КОРЕШКОВА, теперь «производители стран Союза смогут подавать заявления… по единым процедурам и снизить административные издержки».
Согласно первоначальному замыслу, для единого рынка будет введен ряд наднациональных норм. Единым образом для всех стран-участниц будет регулироваться разработка лекарств, проведение доклинических и клинических исследований, контроль качества, регистрация, производство и распределение готового продукта. Это позволит, по мнению Корешкова, «обеспечить своеобразную «санацию» фармацевтического рынка, удалив с него лекарственные препараты, эффективность и безопасность которых не полностью изучены». Впрочем, вопросы выдачи разрешений на проведение исследований, ценообразования, закупок и рекламы все еще будут регулироваться на национальном уровне.
Для того чтобы переход от национального к наднациональному контролю был максимально плавным, предусмотрен специальный переходный период. До 31 декабря 2020 года производители лекарств смогут сами выбирать, по каким правилам регистрировать свою продукцию – национальным или единым. К концу 2025 года все лекарственные средства и медицинские изделия, зарегистрированные по национальным распорядкам, должны будут пройти перерегистрацию в соответствии с единым распорядком.
Впрочем, хотя официальный старт рынка и был назначен на 6 мая, пресс-служба ЕЭК уточняет, что пока что он будет работать лишь формально. Как сообщает «Фармацевтический вестник» (РФ) со ссылкой на слова заместителя начальника отдела координации работ в сфере обращения лекарственных средств и медицинских изделий Департамента технического регулирования и аккредитации ЕЭК Дмитрия ЩЕКИНА, единая информационная система для работы единого рынка пока что не функционирует, а без нее децентрализованная регистрация лекарственных средств невозможна. Предполагается, что разработка завершится осенью 2017 года.
ДЛЯ СОЗДАНИЯ ИММУНОМОДУЛЯТОРА
УЧЕНЫЕ РАСКРЫЛИ СЕКРЕТ КАЗАХСКОГО ЦВЕТКА

Томские ученые получили из казахского цветка ферулы соединение, которое обладает сильным иммуномодулирующим действием. Теперь они планируют синтезировать его в лаборатории, чтобы создать на его основе новое лекарство для регулирования работы иммунной системы.
Ученые Томского политехнического университета вместе с зарубежными коллегами исследовали биологическую активность компонентов, выделенных из произрастающего в Казахстане растения ферулы. Его экстракты используются при лечении воспалительных и инфекционных заболеваний. Ученые выяснили, что лечебные свойства эфирным маслам растения дает особый изомер. Теперь политехники собираются синтезировать его в лабораторных условиях, чтобы создать на его основе новое иммунномодулирующее лекарство.
Не отстают от российских коллег и наши эксперты. Помимо основной деятельности наши сотрудники занимаются научной и исследовательской работой на базах казахстанских фармацевтических предприятий. А. КЕСИКОВА, кандидат фармацевтических наук, заместитель начальника управления фармацевтической экспертизы лекарственных средств, и Т. ЖИЕНБАЕВ, главный эксперт департамента специализированной экспертизы лекарственных средств Национального центра экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники МЗ РК опубликовали в апрельском номере журнала «Фармация Казахстана» результаты своих исследований в статье
«Технология сбора, сушки и хранения лекарственного растительного сырья корни ферулы перистонервной (Ferula penninervis)». Результаты исследования накопления биологически активных веществ в растении позволили установить оптимальный период сбора сырья в фазах вегетации: до и в период цветения, что очень важно для производства лекарственного средства на его основе.
Российские же ученые проанализировали химический состав эфирных масел ферулы и смоделировали, как ведут себя их компоненты в клетках живых организмов. Разделив экстракты эфирных масел ферулы на компоненты, они выяснили, что основными среди них являются цис- и транс-изомеры втор-бутилпропенилдисульфида. Далее исследователи попытались узнать, какой из этих изомеров отвечает за противовоспалительную и иммуномодулирующую активность растения.
«Мы смоделировали взаимодействие цис- и транс-изомеров производного дисульфида с биомишенью в живом организме, – рассказал профессор кафедры биотехнологии и органической химии ТПУ Андрей ХЛЕБНИКОВ. Биомишень – фермент, рецептор, ионный канал или иная биологическая структура, играющая ключевую роль в возникновении или лечении болезни. Лекарство является действенным именно тогда, когда имеет наибольшее сродство к биомишени, подходит к ней, как ключ к замку. Проведя молекулярное моделирование, мы выяснили, что таким «ключиком» у ферулы является именно цис-изомер втор-бутилпропенилдисульфида. Благодаря ему это растение и приобретает свои лечебные свойства».
Теперь ученые пытаются найти метод синтеза лечебного соединения, чтобы получить иммунномодулирующее лекарство против вирусных и воспалительных заболеваний. По словам Андрея Хлебникова, выделять ценный лекарственный компонент из самого цветка более затратно и трудоемко, тем более что лечебные свойства конкретного растения во многом зависят от времени года и условий произрастания.
редакция журнала
«Фармация Казахстана»
ВОЗ ВЫСТУПАЕТ С ГЛОБАЛЬНОЙ ИНИЦИАТИВОЙ ПО СОКРАЩЕНИЮ ЧИСЛА ОШИБОК ПРИМЕНЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ДВА РАЗА В ТЕЧЕНИЕ 5 СЛЕДУЮЩИХ ЛЕТ

Всемирная организация здравоохранения (ВОЗ) выступила с глобальной инициативой, направленной на сокращение числа предотвратимых случаев нанесения серьезного ущерба здоровью в результате ошибок применения лекарственных средств во всех странах на 50% в течение пяти следующих лет.
Глобальная инициатива по защите пациентов от ошибок применения лекарственных средств направлена на устранение слабых мест в системах здравоохранения, которые приводят к ошибкам применения лекарственных средств и нанесению тем самым серьезного ущерба здоровью пациентов. Инициатива послужит поиску способов повышения безопасности назначения, выдачи/отпуска и приема лекарственных средств и повышения осведомленности пациентов о рисках, связанных с неправильным использованием лекарственных средств.
От ошибок применения лекарственных средств каждый день умирает один человек. Ежегодно только в Соединенных Штатах Америки в связи с такими ошибками причиняется ущерб здоровью приблизительно 1,3 млн человек. Несмотря на то, что частота возникновения нежелательных последствий приема лекарственных препаратов является сопоставимой в странах с низким и средним уровнем доходов и странах с высоким уровнем доходов, негативное воздействие, выраженное в числе потерянных лет здоровой жизни, в первой группе стран выше в два раза. Во многих странах нет надежной статистики, и ее сбор планируется в рамках осуществления данной инициативы.
По оценкам экспертов, во всем мире экономический ущерб, связанный с ошибками применения лекарственных средств, составляет $42 млрд в год, то есть почти 1% совокупных глобальных расходов на здравоохранение.
«Каждый из нас, принимая лекарства, рассчитывает на то, что это ему поможет, а не навредит, – говорит д-р Маргарет ЧЕН, Генеральный директор ВОЗ. – Ошибки применения лекарственных средств не только наносят ущерб здоровью людей, но и ложатся колоссальным, ненужным бременем на бюджеты здравоохранения. Предупреждение ошибок позволит экономить деньги и спасать жизни».
Каждому человеку в мире рано или поздно потребуется принимать лекарства для профилактики или лечения какого-либо заболевания. Тем не менее, лекарственные средства иногда могут нанести серьезный ущерб здоровью, если они применяются неправильно, без должного наблюдения, или же в случае ошибки, случайности или проблем с коммуникацией.
Как медицинские работники, так и пациенты могут совершать ошибки, способные привести к серьезному ущербу для здоровья при заказе, назначении, отпуске, подготовке, введении или приеме лекарственных средств. Ошибки могут совершаться при выборе лекарственного средства, определения правильной дозировки или правильного момента приема. Тем не менее, все ошибки применения лекарственных средств являются потенциально предотвратимыми. Предупреждение ошибок и связанного с ними ущерба для здоровья требуют создания систем и процедур, которые обеспечат выбор правильного лекарственного препарата, правильной дозы, правильного пути введения и правильного момента приема.
Ошибки применения лекарственных средств, кроме прочего, могут быть следствием усталости медицинских работников, перегруженности больниц, нехваткой персонала, низким уровнем подготовки и предоставлением пациентам неправильной информации.
Эти причины по отдельности или в сочетании друг с другом могут оказать негативное влияние на процессы назначения, выдачи/отпуска, приема лекарственных препаратов и мониторинга курса лечения, что может привести к серьезному ущербу для здоровья пациента, инвалидности и даже смерти.
В большинстве случаев ущерб для здоровья становится следствием системных проблем в организации и координации оказания медицинской помощи, особенно в тех случаях, когда в оказании медицинской помощи пациенту участвует множество медицинских работников. Наилучшие условия для безопасного оказания медицинской помощи могут быть созданы за счет формирования организационной культуры, для которой характерно систематическое использование передовой практики и отсутствие осуждения в случае совершения ошибки.
В рамках Инициативы к странам обращен призыв в приоритетном порядке принять упредительные меры по коррекции этих ключевых факторов:
- создать перечни лекарственных средств с высоким риском ущерба для здоровья в случае неправильного использования;
- принять меры по обеспечению безопасности пациентов, принимающих несколько лекарственных средств для лечения различных болезней и состояний;
- принять меры по обеспечению безопасности пациентов при переходе от одного врача к другому в целях сокращения потенциала для ошибок применения лекарственных средств и ущерба для здоровья пациентов.
Запланированные в рамках инициативы мероприятия будут реализовываться по четырем направлениям:
- работа с пациентами и общественностью; работа с медицинскими работниками; лекарственные средства как тип продукта;
- системы и практика применения лекарственных средств.
Цель Инициативы – добиться улучшений на каждом этапе процесса применения лекарственных средств, включая назначение, отпуск/выдачу, введение, мониторинг и применение. Задача ВОЗ – предоставить рекомендации и разработать стратегии, планы и методические материалы, необходимые для того, чтобы безопасность пациентов была центральным элементом процесса применения лекарственных средств во всех учреждениях здравоохранения.
«На протяжении многих лет мне не раз доводилось разговаривать с людьми, потерявшими близких в результате ошибок применения лекарственных средств, – говорит д-р Лиам ДОНАЛЬДСОН, Посланник ВОЗ по вопросам безопасности пациентов. – Я был глубоко тронут тем, с каким спокойствием, достоинством и принятием они говорили о ситуациях, которые на самом деле никогда не должны были произойти. Эта Инициатива должна быть посвящена памяти всех тех, кто умер в результате инцидентов, связанных с нарушением принципов безопасности пациентов».
Данная Инициатива – третья глобальная инициатива ВОЗ в области безопасности пациентов после инициативы «Clean Care is Safe Care» (2005 г.), посвященной гигиене рук, и инициативы «Safe Surgery Saves Lives» (2008 г.).
Г-н Simeon BENNETT,
департамент коммуникации ВОЗ
СК-ФАРМАЦИЯ» БУДЕТ ОНЛАЙН ТРАНСЛИРОВАТЬ КОНКУРС
НА ЗАКЛЮЧЕНИЕ ДОЛГОСРОЧНЫХ ДОГОВОРОВ
 3 мая 2017 года состоится процедура вскрытия конвертов с конкурсными заявками на заключение долгосрочных договоров поставки лекарственных средств и изделий медицинского назначения, поступивших от иностранных и казахстанских инвесторов и отечественных товаропроизводителей.
3 мая 2017 года состоится процедура вскрытия конвертов с конкурсными заявками на заключение долгосрочных договоров поставки лекарственных средств и изделий медицинского назначения, поступивших от иностранных и казахстанских инвесторов и отечественных товаропроизводителей.
Проведение процедуры конвертов с конкурсными заявками будет транслироваться в режиме реального времени. Наблюдать за работой тендерной комиссии можно будет через сайт www.sk-pharmacy.kz и на официальной странице Фейсбук Единого дистрибьютора.
Конкурс был объявлен 11 апреля 2017 года на 772 лекарственных средств и 1 367 изделий медицинского назначения.
Объявление и номенклатура с указанием международного непатентованного наименования или состава лекарственных средств, изделий медицинского назначения и их технические характеристики, длительность периода поставки по каждому наименованию лекарственных средств, изделий медицинского назначения, размещены на официальном сайте Единого дистрибьютора (www.sk-pharmacy.kz).
Заключение долгосрочных договоров поставки – беспрецедентный шаг со стороны государства, гарантирующий потенциальному инвестору 10-летний рынок сбыта готовой продукции при условии своевременного и качественного исполнения обязательств по договору.
Данная мера государственной поддержки отечественных производителей позволяет сохранить привлеченные инвестиций, способствует устойчивому развитию фармацевтической отрасли и внедрению международных стандартов в производство с повышением качества выпускаемой продукции. На сегодняшний день заключено 29 долгосрочных договоров на 765 наименований ЛС и ИМН, из них уже поставляется 288 наименований (38%), остальные будут реализованы до 2021 года.
Процедура вскрытия конвертов с конкурсными заявками на заключение долгосрочных договоров пройдет 3 мая 2017 года. Начало процедуры вскрытия конвертов с конкурсными заявками – 11 часов по времени Астаны, в конференц-зале офиса ТОО «СК-Фармация» (г. Астана, ул. Кунаева, 14/3).
ГОСУДАРСТВО БУДЕТ РЕГУЛИРОВАТЬ ЦЕНЫ НА ВСЕ ЛЕКАРСТВА
На брифинге после заседания Правительства РК министр здравоохранения РК Елжан БИРТАНОВ сообщил, что в разработке ведомства находится концепция законопроекта по ценовому регулированию в розничной сети.
«Концепция законопроекта по ценовому регулированию лекарств в розничной сети разработана. С завтрашнего дня мы начинаем ее обсуждение. Сначала на общественном совете, далее на базе Национальной палаты предпринимателей и в СМИ», – уточнил министр. По его словам, документ должен пройти все циклы обсуждения в обществе. «Планируется его направление в парламент осенью этого года. Надеемся, до конца года его принять, с 1 января 2018 года зафиксировать предельные цены на все лекарства в розничной торговле», – сказал глава ведомства.
Также Е. Биртанов поделился информацией о закупе лекарственных препаратов в рамках оказания гарантированной бесплатной медицинской помощи. На эти цели в настоящее время направляется 90 миллиардов тенге. «Мы сегодня около 90 миллиардов тенге направляем на закуп и предоставление бесплатных лекарств на амбулаторном уровне, то есть по рецептам врачей. Из этой суммы на 50 миллиардов тенге мы закупаем через единого дистрибьютора. Данные закупки давно произведены, и поставки этих лекарственных препаратов во все регионы идут. Мониторинг показывает, что более 100% от потребности поставлено, то есть с запасом», – заметил Е. Биртанов.
Что касается второй части (это около 40 миллиардов тенге), то на них закуп осуществляют местные исполнительные органы. «Здесь, к сожалению, мы видим по ряду регионов задержку с проведением тендеров на услуги аптек. То есть аптеки участвуют в конкурсе, получая право бесплатной выдачи, и им за это государство платит соответствующие деньги. К сожалению, эта ситуация из года в год повторяется, поэтому мы сегодня уже разработали меры.
Он добавил, что, в соответствии с этой новой концепцией, теперь уже единый дистрибьютор будет полностью по всей стране отвечать за своевременную доставку и учет этих препаратов, чтобы срывов закупа лекарств не было. «Соответственно, завтра мы эту модель представим на обсуждение общественности, для ее реализации необходима дискуссия с бизнесом», – заключил министр.
zakon.kz.
МИНИСТР ЕЭК В. КОРЕШКОВ:
ЛЕКАРСТВА БУДУТ СВОБОДНО ОБРАЩАТЬСЯ В ЕАЭС
Создание в Евразийском экономическом союзе (ЕАЭС) Фармакопеи – единого свода требований к качеству лекарств – необходимо не только для производства качественных лекарственных препаратов, но и для стабильного развития в союзе фармацевтической промышленности. В итоге граждане стран ЕАЭС будут обеспечены безопасными и качественными лекарствами.
 Об этом заявил министр по техническому регулированию Евразийской экономической комиссии (ЕЭК) Валерий КОРЕШКОВ в Страсбурге (Франция) на встрече с директором Европейского директората по качеству лекарственных средств и здравоохранению (EDQM) Сюзанн КАЙТЕЛЬ. Стороны обсудили совместные шаги по стандартизации качества лекарств.
Об этом заявил министр по техническому регулированию Евразийской экономической комиссии (ЕЭК) Валерий КОРЕШКОВ в Страсбурге (Франция) на встрече с директором Европейского директората по качеству лекарственных средств и здравоохранению (EDQM) Сюзанн КАЙТЕЛЬ. Стороны обсудили совместные шаги по стандартизации качества лекарств.
«При создании Фармакопеи союза мы опираемся, прежде всего, на лучший европейский опыт, нашедший отражение в Европейской фармакопее, – подчеркнул В. Корешков. – Она определяет оптимальные требования для каждого препарата, что гарантирует их высокое качество. Мы ставим задачу: добиться в ЕАЭС как минимум такой же свободы обращения качественных лекарств, отвечающих потребностям здравоохранения и международной торговли».
Гармонизация в рамках союза национальных требований к качеству лекарств, по мнению участников встречи, может стать событием глобального масштаба – вторым региональным проектом в мире после Европейской фармакопеи и первым – на евразийском пространстве. Создание Фармакопеи Евразийского союза придаст новый импульс международным торговым отношениям в этой сфере.
При этом Сюзанн Кайтель отметила, что «разработка любой фармакопейной статьи не должна становиться барьером для вывода на рынок копий лекарственных средств – дженериков, необходимо дать фармацевтическому бизнесу удобный инструмент, стандарт того, какое качество лекарственного препарата нужно нашим потребителям».
В рамках встречи были затронуты вопросы организации системы прослеживания лекарственных средств от производителя до аптечной сети, так называемой «сериализации» лекарств, которая нацелена на предотвращение вывода на рынок контрафактных и фальсифицированных препаратов. «Сейчас не только Европейский союз, но и США, Турция, Россия, Казахстан проводят работы по сериализации лекарственных средств с использованием различных стандартов и подходов, – сказал министр ЕЭК. – Полагаю, следует обратить на это внимание, чтобы фармпроизводители не были вынуждены впоследствии использовать несколько дублирующих модулей оборудования и информационных систем для обеспечения сериализации».
Делегация ЕЭК посетила лабораторный корпус EDQM и производственный участок по выпуску, аттестации и хранению стандартных фармакопейных образцов Европейской и Международной фармакопей. С лабораториями EDQM, производящими стандартные образцы, уже напрямую работают профильные организации Беларуси и Казахстана, отметили в пресс-службе ЕЭК.
По итогам встречи достигнута договоренность о дальнейшем взаимодействии по созданию региональных фармакопей. Представители EDQM выразили
желание участвовать в работе Фармакопейного комитета ЕАЭС в качестве наблюдателей и предложили предоставить комиссии доступ к оригинальным текстам Европейской фармакопеи.
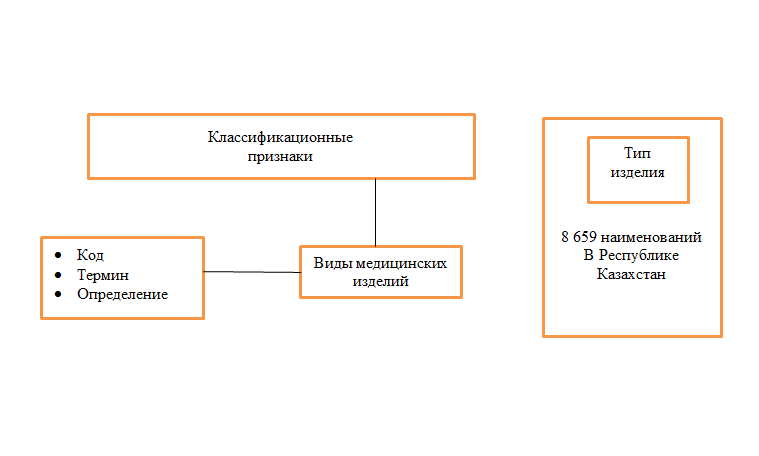
НОМЕНКЛАТУРА МЕДИЦИНСКИХ ИЗДЕЛИЙ
РЕСПУБЛИКИ КАЗАХСТАН
На сегодня в мире существует более 500 000 наименований изделий медицинского назначения и медицинской техники. При решении многих задач в здравоохранении возникает необходимость точно идентифицировать медицинское изделие.
 Для классификации и разделения на виды (группы) существует множество действующих номенклатур и классификаторов. В данной статье рассматривается проект Номенклатуры медицинских изделий Республики Казахстан, структура которой гармонизирована с Глобальной номенклатурой медицинских изделий (Global Medical Device Nomenclature – GMDN).
Для классификации и разделения на виды (группы) существует множество действующих номенклатур и классификаторов. В данной статье рассматривается проект Номенклатуры медицинских изделий Республики Казахстан, структура которой гармонизирована с Глобальной номенклатурой медицинских изделий (Global Medical Device Nomenclature – GMDN).
Производители медицинских изделий дают фирменные наименования своей продукции, стремясь отразить в нем представление о назначении, области применения и технических особенностях изделия. Но в силу большого разнообразия назначения, принципов действия и технических вариантов это далеко не всегда можно понять по фирменному наименованию МИ. Еще большие трудности возникают при решении обратной задачи: при попытке, например, выбрать из базы зарегистрированных медицинских изделий однотипные изделия обнаруживается, что они могут иметь разные фирменные наименования, поэтому в принципе невозможно гарантировать, что будут выбраны все искомые.
Для решения данной проблемы каждому медицинскому изделию наряду с его фирменным наименованием необходимо присвоить стандартизованное, «номенклатурное» наименование. Национальным центром экспертизы ЛС ИМН и МТ по поручению Министерства здравоохранения и социального развития Республики Казахстан разрабатывается проект Номенклатуры медицинских изделий Республики Казахстан – НМИРК, являющийся систематизированным номенклатурным классификатором видов медицинских изделий (изделий медицинского назначения и медицинской техники), гармонизированным с Глобальной номенклатурой медицинских изделий. Для разработки проекта требовалось провести тщательный анализ действующих номенклатур и выбрать оптимальный вариант для Казахстана.
Почему для основы была выбрана GMDN?
Глобальная номенклатура медицинских изделий – система согласованных на международном уровне общих понятий, используемых для идентификации всех медицинских изделий, инициирована в рамках сближения законодательства, регулирующего обращение медицинских изделий, развитых стран, что способствует повышению прозрачности национальных рынков, существенно облегчая работу производителей и поставщиков. Номенклатура GMDN рекомендована к использованию Всемирной организацией здравоохранения (ВОЗ) и фактически является единой платформой идентификации медицинских изделий и международного отраслевого обмена информацией. Номенклатура представляет собой всестороннюю наднациональную систему признаваемых описаний и сопровождаемых кодовыми номерами, в форме предпочтительных терминов и их синонимов с определениями, позволяющими однозначно идентифицировать каждое медицинское изделие.
Деятельность по разработке и ведению номенклатуры координируется Агентством GMDN (Великобритания), объединяющим ведущих мировых экспертов в области классификации медицинских изделий.
История создания глобальной номенклатуры берет свое начало с 1993 года, когда CEN (Европейский комитет по стандартизации) и ISO (Международная организация по стандартизации) разработали стандарт, указывающий структуру для новой международной номенклатуры медицинских изделий. В настоящее время этот стандарт пересмотрен и публикуется как ISO 15225 «Медицинские изделия. Менеджмент качества. Структура данных номенклатуры медицинских изделий», последняя версия которого была опубликована в 2016 году.
В области обращения МИ существует множество субъектов и объектов, имеющих разную направленность деятельности, но преследующих одну цель – обеспечение населения (общества) медицинскими изделиями. Для достижения этой цели необходимо создать общий метод описания и идентификации этих медицинских изделий однозначным образом, что и являлось основной задачей при разработке Глобальной номенклатуры.
В основу GMDN легли шесть существующих номенклатур, которые охватывали широкий спектр наименований и описаний медицинских изделий и продукции, используемой в сфере здравоохранения. В общей сложности сформировалась номенклатура из 13 500 видов. 1 ноября 2001 года GMDN опубликована в качестве отчета Европейского комитета по стандартизации под номером CEN Report CR 14230 и как ISO TS 20225.
На сегодня GMDN является основополагающей номенклатурой, используемой более 80 регуляторами мира, переведенной на 20 языков, включая русский язык. 4 700 производителей из 100 стран являются активными пользователями номенклатуры.
Предпосылки к созданию национальной номенклатуры
В Казахстане отсутствовал систематизированный подход к структурированию медицинских изделий по видам. Для решения этого вопроса РГП на ПХВ «Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники» МЗСР РК (далее – Национальный Центр), учитывая международный опыт и гармонизацию регуляторных подходов страны в сфере обращения медицинских изделий с регуляторными подходами международных организаций (IMDRF – Международный форум регуляторов медицинских изделий), стран Евразийского союза, выбрал для создания основы национальной номенклатуры Глобальную номенклатуру медицинских изделий.
3 июня 2015 года Национальный Центр и Агентство GMDN подписали договор о передаче прав доступа и порядке использования базы GMDN, 26 ноября 2015 года нашей организации был предоставлен административный доступ на сайт GMDN, переданы структура, база данных видов, список классификационных признаков на английском и русском языках.
Эти действия мотивировали регулятора к формированию и внедрению Номенклатуры медицинских изделий Республики Казахстан: началось активное изучение технической стороны вопроса и вариантов подходов к структурированию, кодированию и актуализации информации из GMDN в НМИРК.
25 апреля 2016 года Министерством здравоохранения и социального развития РК утверждена Дорожная карта по созданию и внедрению Номенклатуры медицинских изделий Республики Казахстан (НМИРК), основной задачей которой стал процесс формирования НМИРК и кодирования всех зарегистрированных изделий медицинского назначения и медицинской техники согласно новому классификатору для выполнения последующих задач. С данной задачей Национальный Центр справился успешно, итоги работы высоко оценены Министерством здравоохранения и социального развития.
Следующим шагом для внедрения НМИРК является разработка и совершенствование нормативной правовой базы для создания площадки по внедрению Номенклатуры медицинских изделий в сферу обращения медицинских изделий в Казахстане, на данный момент Национальный Центр совместно с уполномоченным органом в сфере здравоохранения активно ведет работу в данном направлении.
Структура, задачи и функции НМИРК
На данный момент НМИРК – проект систематизированного номенклатурного классификатора видов медицинских изделий (изделий медицинского назначения и медицинской техники), гармонизированный с Глобальной номенклатурой медицинских изделий (GMDN) и применяемый в Республике Казахстан.
НМИРК содержит перечень видов МИ с указанием наименований, кодов и описаний видов медицинских изделий, а также классификационные признаки, используемые для поиска и систематизации видов МИ.
Рисунок 1 – Структура базы данных НМИРК и ее связь с зарегистрированными медицинскими изделиями
Основной функцией НМИРК является разработка единых подходов в структурировании данных и классификации медицинских изделий по видам. Данная функция позволит оптимизировать или решить ряд задач, это:
- государственный контроль качества, эффективности и безопасности медицинских изделий, а именно использование НМИРК при регистрации и пострегистрационном контроле;
- оптимизация системы поиска, закупа и учета медицинских изделий для субъектов здравоохранения;
- обмен информацией с организациями здравоохранения Казахстана и регуляторными органами других стран;
- структурирование данных в системе медицинского страхования;
- включение в стандарты и порядок оказания медицинской помощи;
- включение в систему прослеживания медицинских изделий (UDI система).
Таким образом, разработанная номенклатура медицинских изделий Республики Казахстан позволит создать экспертную систему, обеспечивающую информационную аналитическую поддержку принятия решений при осуществлении государственного регулирования обращения медицинских изделий.
АБДИМАНОВА Б.Ж.,
ЕСБОЛАТОВА Д.Е.,
начальник управления специализированной экспертизы
медицинских изделий,
главный специалист
Департамента стратегического развития и совершенствования законодательства, НЦЭ ЛС, ИМН и МТ, Алматы
ФАРМАЦЕВТИЧЕСКИЙ РЫНОК:
ПЕРСПЕКТИВНЫЕ ТЕХНОЛОГИИ НАСТУПАЮЩЕГО ГОДА
 В наступающем 2017 г. ожидается значительный прогресс по ряду научных направлений, которые в будущем могут превратиться в перспективные коммерческие технологии.
В наступающем 2017 г. ожидается значительный прогресс по ряду научных направлений, которые в будущем могут превратиться в перспективные коммерческие технологии.
По сообщению ffin.ru, в 2017 г. ожидается вынесение решения в патентном споре за правообладание перспективной технологией редактирования генов CRISPR/Cas9.
Компания CRISPR Therapeutics – один из разработчиков технологии CRISPR-Cas9 – уже зарегистрировала в Комиссии по ценным бумагам и биржам (SEC, США) форму S-1 в ходе подготовки к первичному размещению акций. Компания считает технологию CRISPR/Cas9 своей интеллектуальной собственностью. Это мнение опирается на факт, что одним из основателей компании является Эммануэль ШАРПАНТЬЕ, участвовавшая в создании CRISPR.
Конкуренты CRISPR Therapeutics – Editas Medicine Inc. (EDIT, NASDAQ) и Intellia Therapeutics Inc. (NTLA, NASDAQ). Лаборатории пытаются доказать свое авторское право на технологию и получить соответствующие лицензионные отчисления с будущего многомиллиардного рынка.
В 2017 г. ожидается, что FDA одобрит использование фармкомпаниями технологии CAR-T.
Речь идет о типе терапии, при которым должны использоваться генетически модифицированные Т-клетки иммунной системы пациента для борьбы с онкозаболеваниями. Не смотря на то, что во время клинических испытаний произошло несколько летальных исходов, эксперты полагают, что это не помешает терапии получить в 2017 г. одобрение в качестве лекарства от лейкемии и лимфомы. Пока CAR-T – единственный шанс на спасение для многих пациентов.
Здесь первенствуют фармкомпании Kite Pharma (KITE, NASDAQ), объявившая о готовности утверждать свой препарат KTE-C19, и Novartis (NVS, NYSE).
ДОНАЛЬД ТРАМП ПОТРЕБОВАЛ ОТ ГЛАВ ФАРМКОМПАНИЙ СНИЗИТЬ ЦЕНЫ НА ЛЕКАРСТВА В США
Президент США Дональд Трамп встретился с главами фармацевтических компаний, пишет Reuters. Он призвал их снизить цены на свою продукцию. На встрече присутствовали генеральные директора Novartis, Merck, J&J, Celgene, Eli Lilly, а также Amgen и Phrma Industry Group.
По мнению Трампа, медицинские препараты должны вновь производиться в США. Кроме того, он призвал компании снизить цены на свою продукцию. Также президент пообещал, что в скором времени будет объявлен кандидат на должность главы Управления по контроза качеством пищевых продуктов и медикаментов США (FDA).
ВЫДАН ПЕРВЫЙ В МИРЕ СЕРТИФИКАТ GMP
ПРОИЗВОДИТЕЛЮ МЕДИЦИНСКОЙ МАРИХУАНЫ
Датская компания Bedrocan стала первым в мире производителем медицинской марихуаны, получившим сертификат соответствия стандартам GMP Европейского агентства по лекарственным препаратам (EMA).
С 2003 года Bedrocan выпускает сушеную коноплю со стандартизированным содержанием каннабиноидов и терпенов. В настоящее время продукция Bedrocan поставляется для исследовательских и терапевтических целей в Нидерланды, Австралию, Германию, Финляндию, Израиль, Италию, Македонию и Польшу.
Международный стандарт GMP (Good Manufacturing Practice – надлежащая производственная практика) является базовым отраслевым стандартом качества и включает в себя ряд показателей, которым должны соответствовать фармпредприятия, определяя четкие параметры каждого производственного этапа.