НОВЫЙ СПОСОБ «УВИДЕТЬ» РАССЕЯННЫЙ СКЛЕРОЗ И ДРУГИЕ ПРОБЛЕМЫ
Новый радиофармпрепарат, созданный для позитронно-эмиссионной томографии, поможет в диагностике неврологических заболеваний, при которых поражаются нейроны, имеющие на своей мембране глутаматергические рецепторы (NMDA).
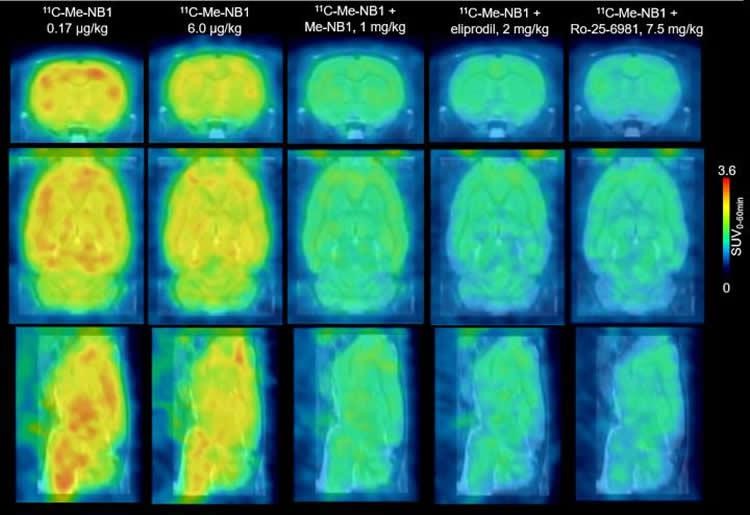 На изображении представлены ПЭТ-сканы мозга с использованием радиофармпрепарата с лигандом 11C-Me-NB1 (0-60 мин), наложенные на шаблон МРТ. Credit: SD Krämer et al., ETH Zurich, Zurich, Switzerland.
На изображении представлены ПЭТ-сканы мозга с использованием радиофармпрепарата с лигандом 11C-Me-NB1 (0-60 мин), наложенные на шаблон МРТ. Credit: SD Krämer et al., ETH Zurich, Zurich, Switzerland.
Этот класс нервных клеток представляет собой одно из главных звеньев процессов запоминания и обучения, поэтому их состояние может стать важным маркером при, например, болезнях Паркинсона, Альцгеймера, рассеянном склерозе. Подробности – в The Journal of Nuclear Medicine.
Швейцарские и немецкие учёные разработали новый радиолиганд для ПЭТ 11C-Me-NB1, позволяющий визуализировать в нервных клетках подтипы NMDA-рецепторов GluN1 или GluN2B. При их гиперактивации, что часто происходит во время неврологических заболеваний, в клетках увеличивается содержание ионов кальция, и слишком большая их концентрация может закончиться клеточной гибелью. Поэтому существующие в практике препараты, которые блокируют рецепторы NMDA, используются для лечения довольно широкого спектра состояний – от депрессии и невралгий до ишемического инсульта и заболеваний, вызывающих деменцию.
«Доступность такого радиолиганда для ПЭТ не только поможет лучше понять роль NMDA-рецепторов в патофизиологии многих заболеваний мозга, но и выбрать соответствующие клинически значимые дозы препаратов, нацеленных на подтип рецептора GluN2B. Такой точный контроль поможет свести к минимуму побочные эффекты и приведёт к повышению эффективности лекарств», – объясняет Саймон М. АМЕТЭМИ (Simon M. Ametamey), исследователь Института фармацевтических наук, в ETH (Цюрих, Швейцария).
Пока лиганд 11C-Me-NB1 прошёл доклиническую стадию. Его проверяли на животных, исследовали дозировки и эффективность элипродила – препарата, блокирующего подтип GluN2B глутаматергического рецептора. ПЭТ-сканирование, проведённое с новым радиолигандом, показало, что при нейропротекторных дозах элипродила рецепторы оказались полностью занятыми. Вещество также обеспечило визуализацию перекрестных Sigma-1-рецепторов, которые модулируют кальциевые взаимодействия.
Исследователи считают, что созданный ими новый радиофармацевтический инструмент присоединится к тем существующим, которые используются для визуализации нейродегенеративных заболеваний. Они также предполагают, что это он поможет и нейрофизиологам, изучающим процессы запоминания и обучения в норме, а также ускорит производство препаратов, тропных к GluN2B и находящихся пока в стадии разработки.
Источник:
Evaluation of 11C-Me-NB1 as a Potential PET Radioligand for Measuring GluN2B-Containing NMDA Receptors, Drug Occupancy, and Receptor Cross Talk by Stefanie D. Krämer, Thomas Betzel, Linjing Mu, Ahmed Haider, Adrienne Müller Herde, Anna K. Boninsegni, Claudia Keller, Marina Szermerski, Roger Schibli, Bernhard Wünsch and Simon M. Ametamey in Journal of Nuclear Medicine. Published April 2018.
doi:10.2967/jnumed.117.200451
Анна ХОРУЖАЯ,
neuronovosti.ru/pet-nmda/
МАРКИРОВКА ЛП НЕ ДОЛЖНА СТАТЬ БАРЬЕРОМ ДЛЯ ЕДИНОГО РЫНКА ЛЕКАРСТВ ЕАЭС
Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки (кодификации) упаковок лекарственных средств не должно стать барьером для их обращения в рамках единого рынка лекарств. Об этом сообщили в Европейской экономической комиссии.
 «Маркировка контрольно-идентификационными знаками потребует совершения производителями лекарственных препаратов определенных действий, предусмотренных законодательством Российской Федерации, но барьером такие требования стать не должны», – отметил начальник отдела координации работ в сфере обращения лекарственных средств и медицинских изделий Европейской экономической комиссии Дмитрий РОЖДЕСТВЕНСКИЙ. Принятый в целях обеспечения функционирования общего рынка лекарственных средств пакет документов Евразийского экономического союза включает решение Совета комиссии от 3 ноября 2016 г. №76, определяющее требования маркировки лекарственных препаратов.
«Маркировка контрольно-идентификационными знаками потребует совершения производителями лекарственных препаратов определенных действий, предусмотренных законодательством Российской Федерации, но барьером такие требования стать не должны», – отметил начальник отдела координации работ в сфере обращения лекарственных средств и медицинских изделий Европейской экономической комиссии Дмитрий РОЖДЕСТВЕНСКИЙ. Принятый в целях обеспечения функционирования общего рынка лекарственных средств пакет документов Евразийского экономического союза включает решение Совета комиссии от 3 ноября 2016 г. №76, определяющее требования маркировки лекарственных препаратов.
Эти требования предусматривают единую маркировку для препаратов, выпускаемых в обращение на территориях государств-членов, при этом в случае наличия различающейся информации (условия отпуска и т.п.) ее указывают с использованием дополнительной этикетки (стикера) в специально отведенном поле вторичной упаковки, пояснил эксперт.
Если на вторичной упаковке предусмотрено предназначенное для специальной информации государства-члена поле, в нем допускается нанесение такой информации (например, разный статус отпуска из аптечной сети или специальная информация: «упаковка для стационаров», «по государственным программам» и др.) без использования этикетки (стикера).
Кроме того, г-н Рождественский пояснил, что прорабатывается вопрос введения системы мониторинга на территории ЕАЭС.
«В Алматы 2 февраля 2018 года подписано Соглашение о маркировке товаров средствами идентификации в Евразийском экономическом союзе, которое еще не вступило в силу, – уточнил сотрудник комиссии. – Процедурно при принятии решения о введении маркировки товаров Советом комиссии будет утвержден перечень таких товаров с указанием их кодов в соответствии с единой ТН ВЭД ЕАЭС. В нем будут определены дата введения и порядок маркировки товаров, средства идентификации, а также состав и структура информации, которая должна содержаться в средствах идентификации на основе сведений (при их наличии), содержащихся в едином реестре средств идентификации».
Вопросами маркировки в комиссии занимается Департамент таможенно-тарифного и нетарифного регулирования. Они обсуждаются с участием представителей бизнеса в экспертных группах по вопросам маркировки лекарственных препаратов, обуви и ювелирных изделий средствами идентификации.
pharmvestnik.ru
ФАКТОРЫ, КОТОРЫЕ ИЗМЕНЯТ ГЛОБАЛЬНОЕ ЗДРАВООХРАНЕНИЕ В БЛИЖАЙШИЕ 5 ЛЕТ
Институтом исследований человеческих данных IQVIA опубликован доклад, отражающий основные тенденции, которые будут определять развитие глобального здравоохранения в ближайшие 5 лет. Согласно отчету, глобальное здравоохранение стоит на пороге ключевых поворотных моментов.
При этом изменения, которые произойдут в 2018 году, будут определять перспективы на ближайшие пять лет и последующие годы. Среди них: разработка принципиально новых лекарственных средств; появление новых технологий и способов сохранения и улучшения здоровья, изменение подходов к расчету стоимости технологий здравоохранения и социальной ценности лекарств.
- Более активное использование доказательств реального мира (Real-World Evidence – RWE) регуляторными органами, плательщиками, исследовательскими центрами и фармацевтическими компаниям.
- Введение в клиническую практику биотерапевтических технологий нового поколения.
За последние десятилетия значительно возросло использование компьютеров и других электронных устройств для сбора и хранения данных, связанных со здоровьем. Это так называемые данные реального мира (Real World Data – RWD), то есть сведения, касающиеся состояния здоровья пациента и/или предоставления медицинской помощи, регулярно собираемые из различных источников (электронные медицинские записи, данные от страховых компаний о возмещении расходов на лечение, сведения о фармаконадзоре, аптечные данные о рецептурных заказах, реестры продуктов и болезней, истории болезни, амбулаторные карты, устройства мониторинга здоровья).
По мере того, как большие данные (Big Data), собранные в условиях реальной клинической практики, становятся более объемными и надежными, они все чаще начинают использоваться в системе здравоохранения в качестве доказательств реального мира (Real-World Evidence – RWE) при оценке эффективности и безопасности лекарств и медицинских технологий, применяемых вне клинических испытаний, то есть в реальной практике.
Данные реального мира уже широко используются держателями бюджетов здравоохранения для принятия решений о возмещении расходов на лекарственные средства. Сравнительно недавно их стали применять спонсоры клинических исследований и регуляторные органы. В первом случае они позволяют лучше, проектируя, проводить клинические исследования, формулировать исследовательские гипотезы и осуществлять набор пациентов, а во втором – принимать решения в отношении безопасности и эффективности продукта после его выхода на рынок. Важно, что использование данных реального мира может способствовать ускорению и удешевлению процессов разработки и одобрения лекарств.
Выпуск первых критериев использования данных реального мира в дополнение к данным, полученным из обычных рандомизированных контролируемых исследований, при одобрении лекарств запланирован FDA на декабрь 2018 года, а выход окончательного руководства – на декабрь 21 года. В результате производители лекарств получат понимание, какие доказательства, основанные на RWE, будет принимать FDA при одобрении лекарств.
Использование RWE позволит сократить расходы производителей на исследования, тем самым ускорит процесс одобрения новых лекарств, комбинированных схем лечения рака, применения уже присутствующих на рынке препаратов по новым показаниям и т.д.
- Введение в клиническую практику биотерапевтических технологий нового поколения.
В медицинскую практику постепенно приходят технологии клеточной и генной терапии, а также регенеративные лекарства, которые при одобрении получают статус «прорывных» методов или препаратов. Их свойства и новизна меняют взгляд на привычное определение того, что представляет собой лекарство как клинически, так и с точки зрения ожиданий результатов, продолжительности лечения и затрат. Некоторые из них подразумевают индивидуальную генную инженерию, давая возможность полного излечения в результате одноразового применения.
В конце прошлого и начале текущего года впервые в мировой истории от FDA получили одобрение две технологии генной терапии CAR-T. Согласно прогнозам IQVIA, в 2018 году будет одобрено 5-8 биотерапевтических методов/препаратов нового поколения. На этапе III фазы клинических исследований находится еще 40-45 новых биологически активных веществ (рисунок 1). Они появятся на рынке в течение следующих пяти лет.
Биотерапевтические методы нового поколения
| Генная терапия | ||
| Адено-ассоциированная вирусная генная терапия | Генетическая терапия | Генная терапия
на основе плазмид |
| Аденовирусная генная терапия | Генетически спроектированная аутологичная клеточная терапия | Ретровирусная генная терапия |
| ДНК-вакцины | Генетически спроектированная аутологичная клеточная вакцина | Целенаправленный ремонт генов |
| Регуляция экспрессии генов | Генная терапия с использованием в качестве вектора герпес-вируса | Использование генов супрессоров опухолей |
| Генная технология | Генная терапия с использованием в качестве векторов липидных наночастиц | Генная терапия с использованием вирусных векторов |
| Система переноса генов | Невирусная генная терапия | |
| Клеточная терапия |
| Клеточная инженерия |
| Клеточная трансплантация |
| Соматическая клеточная терапия |
| Терапия стволовыми клетками |
| Трансплантация стволовых клеток |
| Тканевая инженерия |
| Регенерация тканей |
| Тканевая терапия |
| Ксеногенная, или межвидовая, трансплантация |
Однако стоимость такого лечения чрезвычайно высока по сравнению с традиционными, малыми терапевтическими молекулами. К примеру, за генную терапию В-клеточного острого лимфобластного лейкоза Kymriah (tisagenlecleucel) компанией Novartis Pharmaceuticals была установлена цена в размере $475 000, а гомологичная ей терапия Yescarta (axicabtagene ciloleucel) была оценена Gilead Science в $373 000. Высокая стоимость и разница в ценах CAR-T-терапии от разных компаний разожгла новую дискуссию по поводу роста цен на лекарства, отпускаемые по рецепту.
В ответ на это компания Novartis заявила, что будет взимать плату за терапию Kymriah только в том случае, если пациенты ответят на лечение в течение месяца от начала терапии. Между тем Gilead Science не последовала этому примеру.
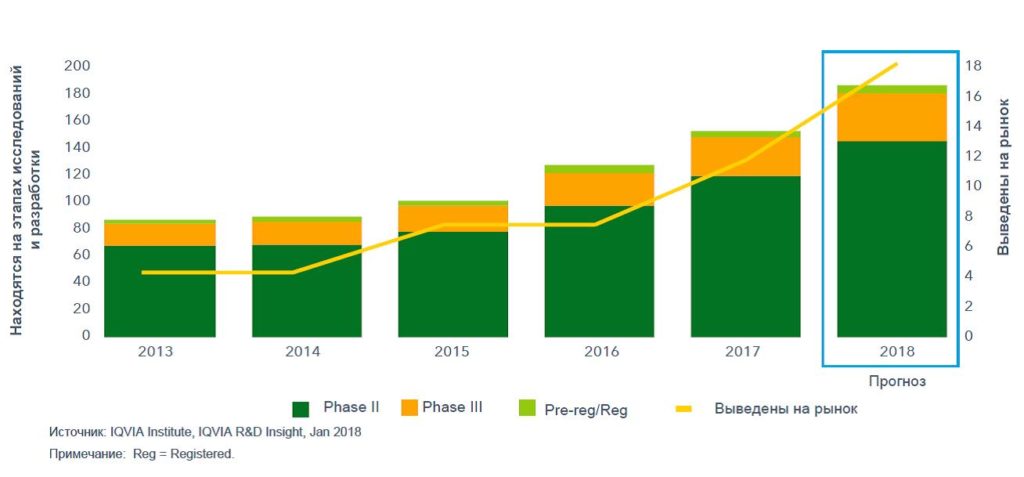 Рисунок 1 – Количество биотерапевтических методов/препаратов следующего поколения, уже присутствующих на рынке и находящихся на поздних стадиях исследований
Рисунок 1 – Количество биотерапевтических методов/препаратов следующего поколения, уже присутствующих на рынке и находящихся на поздних стадиях исследований
Многие из этих революционных подходов слишком новы, чтобы иметь доказанные результаты в плане отдаленной эффективности и безопасности. Сочетание такого рода неопределенности с высокими издержками повлияет на то, как эти лекарства будут оплачиваться и использоваться.
По мере распространения инновационных видов лечения давление на бюджеты систем здравоохранения будет возрастать. Поэтому плательщикам предстоит создать новую схему их оплаты и возмещения, чтобы максимизировать доступ к этим клиническим достижениям.
- Включение цифровых приложений в клинические руководства
Использование инструментов Digital Health, в том числе мобильных приложений для здоровья и носимых медицинских устройств, открывает огромные перспективы в улучшении здоровья человека. Как и в случае с другими новыми технологиями здравоохранения, для их использования в клинической практике требуются доказательства эффективности. И таких доказательств появляется все больше: с 2007 года по август 2017 года опубликовано 571 исследование. В 2018 году, согласно прогнозам IQVIA, будут завершены и опубликованы еще примерно 340 исследований, а в ближайшие 5 лет их количество возрастет до 3500 (рисунок 2). На сегодняшний день уже получены убедительные доказательства эффективности инструментов цифрового здравоохранения в контроле сахарного диабета, депрессии и тревожных расстройств. Процесс создания убедительных доказательств в поддержку цифровых инструментов и вмешательств будет продолжаться, что поспособствует их включению в практические рекомендации.
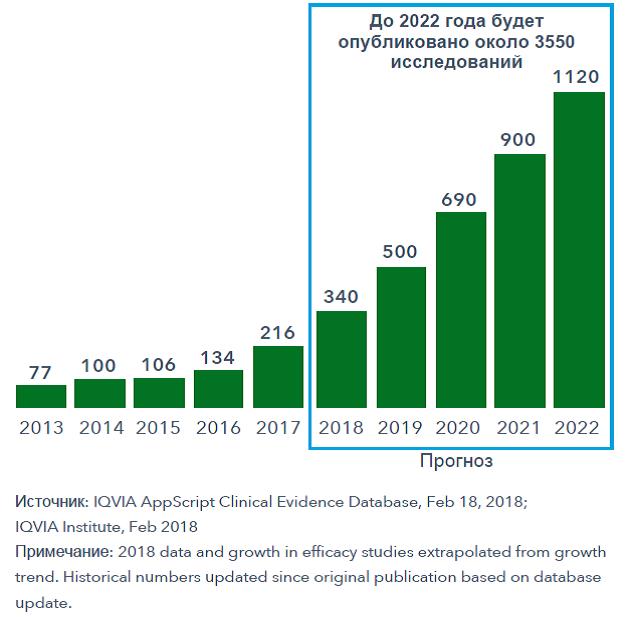
Рисунок 2 – Количество опубликованных исследований эффективности использования
цифровых медицинских технологий
Появление хорошо разработанных приложений и мобильных устройств позволит улучшить результаты лечения, иногда при почти нулевых дополнительных затратах. Они будут охватывать широкий спектр заболеваний, войдут в клинические руководства и протоколы, а их стоимость будет возмещаться плательщиками. Однако предстоит урегулировать вопросы конфиденциальности, безопасности и интеграции технологий в рабочий процесс.
- Расширение использования телемедицины
Благодаря более широкому распространению высокоскоростного интернета, использованию специальных мобильных приложений, а также носимых медицинских устройств появилась возможность обслуживания пациентов посредством телефонных и интернет консультаций (рисунок 3). Сторонники телемедицины утверждают, что во многих случаях очные врачебные приемы могут проводиться удаленно. Обходится такое дистанционное консультирование значительно дешевле, чем традиционные визиты к врачу, что очень важно, учитывая растущие затраты на здравоохранение.
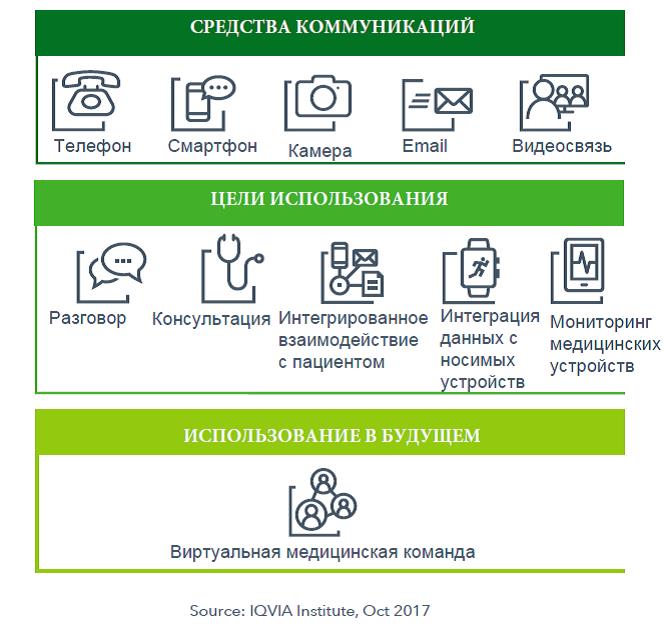
Рисунок 3 – Средства коммуникаций и цели их использования в телемедицине
Согласно прогнозам аналитиков, в 2018 году в США количество телеконсультаций увеличится на 15-40%, достигнув 35-42 млн. Если данная тенденция сохранится, к 2022 году 7,5% врачебных приемов будут осуществляться посредством телеконсультирования.
Следует отметить, что в 2018 году крупные работодатели в США стали применять финансовые стимулы к своим бенефициарам за использование услуг телемедицины. Ожидается, что удобство и экономия затрат приведут к расширению использования телемедицины. В течение следующих пяти лет каждый пациент, вероятно, столкнется с какой-либо формой взаимодействия посредством телекоммуникаций.
Телеконсультации особенно актуальны при ненадлежащем использовании первичной медико-санитарной помощи, а также в тех случаях, когда пациенты злоупотребляют услугами неотложной и скорой помощи. Некоторые страны уже достигли определенных успехов в использовании телекоммуникаций для обслуживания таких пациентов, что позволило им значительно снизить издержки.
- Снижение расходов на оригинальные брендированные лекарства на развитых рынках.
С 2013 по 2017 годы расходы на оригинальные брендированные лекарства на развитых рынках увеличились с $326 до $395. Однако в 2018 году, согласно прогнозам IQVIA, они сократятся на 1-3%, то есть до $391 млрд, и в последующие 5 лет останутся практически неизменными. Производители будут продолжать разрабатывать, затем выводить на рынок новые молекулы, но их будет несколько меньше, чем препаратов, которые потеряют эксклюзивность вследствие окончания срока патентной защиты. Кроме того, свою роль сыграют плательщики и держатели бюджетов, которые будут контролировать цены при обеспечении доступа к новым лекарствам.
- Рост расходов на развитых рынках будут стимулировать специализированные лекарства.
В последнее десятилетие в сегменте новых лекарственных средств наблюдается устойчивый сдвиг в сторону специализированных фармацевтических препаратов (рисунок 4). К ним относятся лекарственные средства для лечения хронических, сложных или редких заболеваний (в том числе онкологических, аутоиммунных заболеваний, гепатита С и других), а также требующие особого администрирования поставщиком медицинских услуг, особых условий при дистрибуции, тщательного фармаконадзора и принятия прочих мер.
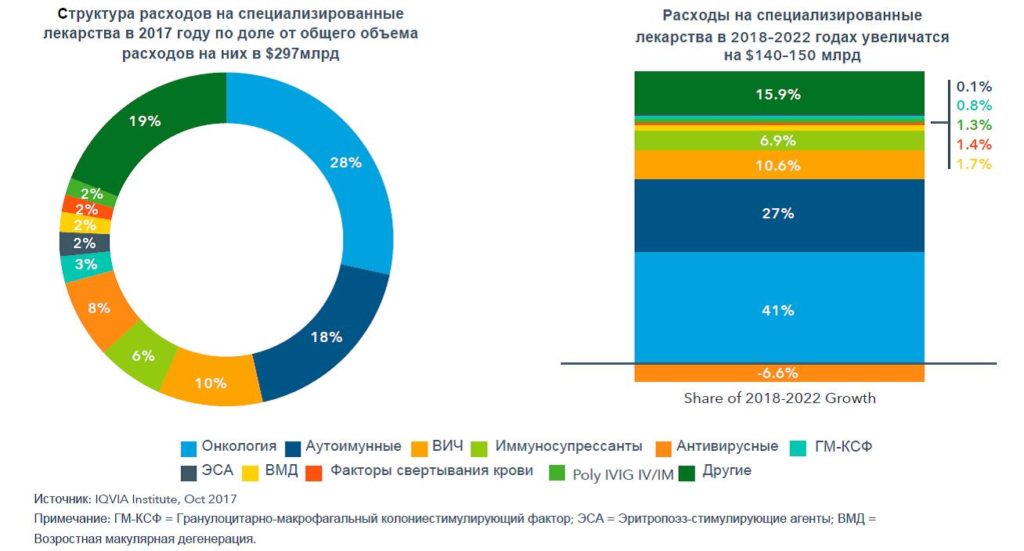 Рисунок 4 – Расходы на специализированные лекарственные средства и рост на развитых рынках
Рисунок 4 – Расходы на специализированные лекарственные средства и рост на развитых рынках
Специализированные продукты будут стимулировать рост расходов на медицину. Их доля в структуре расходов на лекарственные средства на десяти крупнейших рынках будет увеличиваться. Так, в 2017 году она составляла 39% ($297 млрд), в 2018 году, по прогнозам IQVIA, она возрастет до 41% ($318 млрд), а к 2022 году, несмотря на сдерживание цен со стороны регуляторов и плательщиков, достигнет 48%. Отчасти это связано с тем, что у таких препаратов обычно очень мало прямых конкурентов.
- Конкуренция со стороны биосимиляров будет усиливаться.
В настоящее время конкуренция со стороны биосимиляров на развитых рынках невелика. В 2017 году с ней столкнулось лишь 7 из 196 оригинальных биологических молекул с объемом продаж в $26 млрд. Однако, согласно прогнозам, пик окончания сроков патентной защиты на оригинальные биопрепараты на развитых рынках и появления биосимиляров придется на 2019-2022 годы. Они составят конкуренцию оригинальным биопрепаратам с объемом продаж в $52 млрд на развитых рынках, а к 2027 году 77% текущих расходов на биопрепараты будут подвергаться определенной форме конкуренции (рисунок 5).
Преимущества увеличения количества биосимиляров на рынке для потребителя очевидны. Они способствуют экономии затрат, расширяя тем самым доступ к биологической терапии. Однако только время покажет, какая экономия будет сгенерирована биосимилярами.
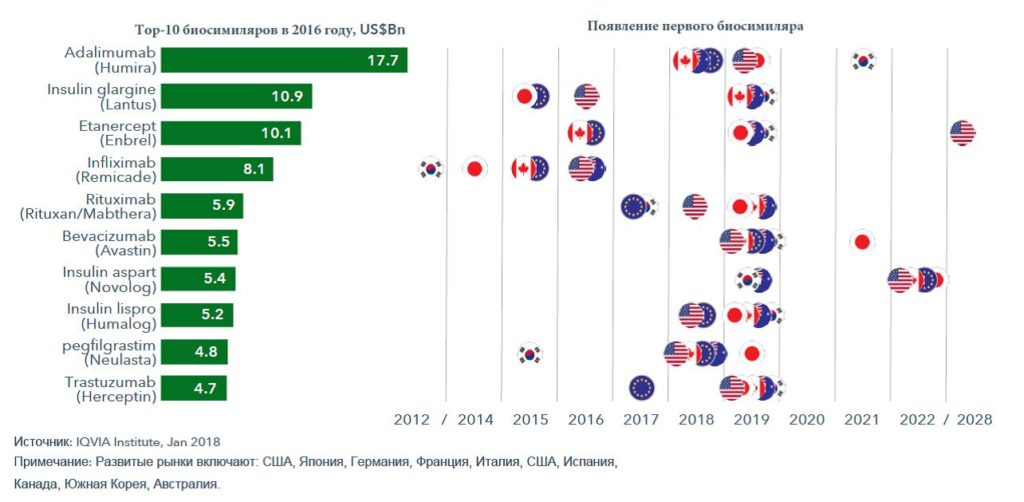 Рисунок 5 –Тор-10 оригинальных биопрепаратов по объему продаж в 2016 году на развитых рынках и появление первых биоподобных конкурентов
Рисунок 5 –Тор-10 оригинальных биопрепаратов по объему продаж в 2016 году на развитых рынках и появление первых биоподобных конкурентов
Среди факторов, которые окажут влияние на глобальное здравоохранение, аналитики IQVIA также называют:
-замедление темпов роста фармацевтических рынков стран, отнесенных к кластеру развивающихся рынков (Pharmerging Markets), некоторое сокращение показателя расходов на лекарства на душу населения в США;
-сдерживание затрат на лечение дорогостоящими лекарствами путем более активного использования схемы оплаты по результату терапии, когда держатели бюджетов платят меньше, если препарат показал себя не столь эффективным, чем было продемонстрировано в клинических исследованиях.
Полная версия отчета, включая подробное описание методологии, доступна на сайте www.IQVIAInstitute.org.
Ольга БАИМБЕТОВА,
Ущерб, связанный с лекарственными ошибками, составляет 42 млрд долларов в год
 Безопасность пациентов является серьезной проблемой общественного здравоохранения во всем мире. У человека имеется один шанс на миллион пострадать при путешествии на самолете. В то же время вероятность причинения вреда пациенту при оказании медицинской помощи составляет 1 к 300.
Безопасность пациентов является серьезной проблемой общественного здравоохранения во всем мире. У человека имеется один шанс на миллион пострадать при путешествии на самолете. В то же время вероятность причинения вреда пациенту при оказании медицинской помощи составляет 1 к 300.
Показатели безопасности в отраслях, которые считаются более опасными, такие как авиация и ядерная промышленность, намного выше, чем в области здравоохранения. ВОЗ опубликовала 10 фактов о безопасности пациентов.
Факт 1. Причинение вреда пациенту занимает четырнадцатое место среди причин глобального бремени болезней, что сопоставимо с такими заболеваниями, как туберкулез и малярия.
По имеющимся оценкам, число госпитализаций в мире достигает 421 миллиона в год. При этом примернов 42,7 миллионов случаев у госпитализированных пациентов происходят побочные эффекты. Согласно последним данным, причинение вреда пациенту занимает четырнадцатое место среди причин заболеваемости и смертности во всем мире.
Факт 2. Здоровью каждого десятого пациента причиняется вред во время пребывания в больнице.
По оценкам, здоровью каждого десятого пациента в странах с высоким уровнем доходов причиняется вред во время его пребывания в больнице. Этот вред может быть вызван целым рядом ошибок или побочных эффектов, и почти 50% из них являются предотвратимыми. Результаты изучения частоты случаев и предупреждаемости побочных эффектов в 26 странах с низким и средним уровнями доходов (СНСД) показывают, что частота случаев составляла около 8%, из которых 83% могли быть предупреждены, а 30% привели к смертельному исходу. Примерно две трети всех случаев побочных эффектов происходят в СНСД.
Факт 3. Небезопасное применение лекарственных средств причиняет вред здоровью миллионов людей и наносит финансовый ущерб, измеряемый миллиардами долларов в год.
Небезопасная практика приема лекарственных препаратов и лекарственные ошибки являются главной причиной предотвратимых случаев причинения вреда в системах здравоохранения во всем мире. Согласно оценкам, размер ущерба, связанного с лекарственными ошибками, во всем мире составляет 42 миллиарда долл. США в год, не считая потери заработка, снижения производительности труда или расходов на медицинскую помощь. Это составляет почти 1% расходов на нужды здравоохранения во всем мире. Лекарственные ошибки могут происходить в результате неэффективности систем медикаментозной терапии, и/или под влиянием человеческого фактора. Как например, усталость сотрудников, плохие условия труда, нарушения рабочего процесса и сокращения кадров — все эти факторы могут оказывать отрицательное влияние на назначение, интерпретирование, выдачу, регулирование и контроль лекарственных средств во врачебной практике, что в свою очередь может приводить к нанесению вреда, инвалидности или даже смерти.
Факт 4. 15% средств на нужды здравоохранения расходуются непроизводительно в связи с различными аспектами побочных эффектов.
Недавно полученные данные показывают, что 15% общего объема средств медицинских стационарных учреждений, расходуемых на ведение деятельности, в странах ОЭСР (Организации экономического сотрудничества и развития) непосредственно связаны с побочными эффектами и их последствиями, включая венозную тромбоэмболию, пролежни и инфекции. Согласно оценкам, общий объем издержек, связанных с нанесением вреда, только в этих странах достигает триллионов долларов США в год.
Факт 5. Инвестиции, направленные на сокращение числа инцидентов, касающихся безопасности пациентов, могут обеспечить значительную экономию финансовых средств.
Инвестиции, направленные на сокращение числа инцидентов, касающихся безопасности пациентов, могут обеспечить значительную экономию финансовых средств, а также улучшение результатов лечения. Только в США целенаправленные меры по повышению уровня безопасности позволили сэкономить примерно 28 млрд. долл. США в больницах системы Medicare за период с 2010 по 2015 годы.
Факт 6. На каждые 100 госпитализированных пациентов приходится 14 случаев внутрибольничных инфекций
В каждый отдельно взятый момент времени на каждые 100 госпитализированных пациентов приходится 7 случаев инфекций, приобретенных в связи оказанием медико-санитарной помощи в странах с высоким уровнем доходов и 10 случаев в странах с низким и средним уровнями доходов, в результате чего во всем мире страдают сотни миллионов пациентов. В странах Европейского союза ежегодно регистрируется около 3,2 миллионов случаев внутрибольничных инфекций, а 37 000 пациентов погибают от их прямых последствий. Простые меры профилактики инфекций и инфекционного контроля, такие как надлежащая гигиена рук, могут снизить частоту внутрибольничных инфекций более чем на 50%.
Факт 7. Более одного миллиона пациентов погибают ежегодно от послеоперационных осложнений.
Данные ВОЗ показывают, что показатели заболеваемости и смертности в связи с хирургическими операциями остаются высокими во всем мире; не менее 7 миллионов человек в год становятся инвалидами в результате послеоперационных осложнений, а более одного миллиона человек погибают. Показатели смертности в интраоперационный период и связанной с анестезией постепенно снижаются за последние 50 лет, частично в результате усилий, направленных на повышение безопасности пациентов при проведении хирургического вмешательства. Однако же они остаются в два-три раза выше в странах с низким и средним уровнями доходов, чем в странах с высоким уровнем доходов.
Факт 8. Неправильный или поздний диагноз приводит к отрицательным последствиям на всех этапах оказания медицинской помощи и наносит вред недопустимо большому числу пациентов.
Проведенные исследования показывают, что не менее 5% взрослого населения США ежегодно становятся жертвами диагностической ошибки в поликлинических учреждениях. Недавно проведенное исследование по изучению результатов патологоанатомического вскрытия в течение нескольких десятилетий показало, что на долю диагностических ошибок приходится примерно 10% случаев смерти среди пациентов в США. В Малайзии результаты поперечного исследования, проведенного в пунктах первичной медицинской помощи показали, что уровень распространенности диагностических ошибок составляет 3,6%. Данные медицинского учета также свидетельствуют о том, что на долю диагностических ошибок приходится от 6% до 17% всех случаев побочных эффектов в больницах.
Объем данных, касающихся стран с низким и средним уровнями доходов, ограничен; однако ожидаемые значения этих показателей выше, чем в странах с высоким уровнем доходов, поскольку на процесс диагностики дополнительно влияют такие факторы, как ограниченный доступ к медицинской помощи и диагностическим тестам, недостаточный уровень квалификации специалистов в учреждениях первичной медико-санитарной помощи, а также системы регистрации на бумажных носителях.
Факт 9. Использование радиационного излучения повысило эффективность медицинской помощи, однако использование методов лучевой терапии в медицинских целях создает угрозу для общественного здоровья и безопасности.
Использование ионизирующего излучения в медицинских целях является важнейшим отдельно взятым искусственным источником радиации, оказывающим воздействие на население. Во всем мире ежегодно проводятся более 3,6 миллиарда рентгенологических обследований, в том числе примерно 10% у детей. Кроме того, ежегодно проводится более 37 миллионов процедур ядерной медицины и 7,5 миллионов процедур радиотерапии. Неправильное или неквалифицированное применение радиационного излучения в медицинских целях может создавать опасность как для пациентов, так и для работников здравоохранения.
Факт 10. На долю административных ошибок приходится до половины всех случаев медицинских ошибок в системе первичной помощи.
По данным недавно проведенных обзоров литературных источников, частота медицинских ошибок в системе первичной помощи составляет от 5 до 80 на 100 000 обращений. Наиболее распространенными видами ошибок в рамках первичной помощи являются административные ошибки, связанные с системами и процессами предоставления помощи. Согласно оценкам, от 5% до 50% всех медицинских ошибок в рамках первичной помощи являются административными ошибками.
gmpnews.ru
ПОВЫШАЮТСЯ СУММЫ ВЗНОСОВ ДЛЯ ЗАЯВИТЕЛЕЙ ЗА РЕГИСТРАЦИОННЫЕ ПРОЦЕДУРЫ EMA
 Общие взносы в Европейское агентство по лекарственным средствам (European Medicines Agency — ЕМА) для заявителей или владельцев маркетинговой лицензии, не связанные с фармаконадзором, повышаются на 1,7% с 1 апреля 2018 г.
Общие взносы в Европейское агентство по лекарственным средствам (European Medicines Agency — ЕМА) для заявителей или владельцев маркетинговой лицензии, не связанные с фармаконадзором, повышаются на 1,7% с 1 апреля 2018 г.
Ежегодно 1 апреля ЕМА пересматривает размер взносов в соответствии с уровнем инфляции в Европейском Союзе (ЕС) за предыдущий год. Нынешний рост отражает уровень инфляции за 2017 г., опубликованный статистическим управлением Европейского Союза.
Все заявки, полученные до 31 марта, будут оцениваться относительно предыдущих тарифов, и только для заявок, полученных после этой даты, тарификация проходит по новому расчету.
Так, размер взносов ЕМА на период с 1 апреля 2018 по 1 апреля 2019 г. составляет:
|
apteka.ua
БАКТЕРИИ С «НЕОБЫЧНОЙ» АНТИБИОТИКОРЕЗИСТЕНТНОСТЬЮ ШИРОКО РАСПРОСТРАНЕНЫ В США

Центры по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention – CDC) сообщают, что в прошлом году в США было выявлено более 220 бактерий с «необычными» генами устойчивости к антибиотикам.
Они включают бактерии, которые:
- устойчивы к большинству (или всем) известным антибиотикам;
- распространены на нехарактерной для них географической территории;
- имеют специфические гены, которые позволяют им «делиться» антибиотикорезистентностью с другими бактериями.
Быстрое выявление новых или редких инфекционных угроз является важнейшим первым шагом в стратегии сдерживания распространения антибиотикорезистентности в США. Данная стратегия требует быстрой идентификации резистентности у микроорганизмов, оценки инфекционного контроля, тестирования пациентов без симптомов, которые могут переносить и распространять опасные бактерии, и продолжение оценки инфекционного контроля до прекращения распространения возбудителя. Это реализуется с помощью скоординированных ответных мер между медицинскими учреждениями, лабораториями, департаментами здравоохранения и CDC через сеть AR Lab.
Новые данные свидетельствуют о том, что стратегия сдерживания распространения антибиотикорезистентности в США может предотвратить тысячи трудно подающихся лечению или потенциально неизлечимых инфекций, включая высокоприоритетные угрозы, — таких возбудителей, как Candida auris и устойчивых к карбапенему штаммов энтеробактерий.
По оценкам, благодаря стратегии сдерживания распространения антибиотикорезистентности в США за 3 года было предотвращено до 1600 новых случаев инфекций, вызванных устойчивыми к карбапенему штаммами энтеробактерий только в одном штате.
Микроорганизмы будут постоянно находить способы противостоять новым и существующим антибиотикам. Остановить этот процесс невозможно, однако его можно сдерживать и контролировать, чтобы не допустить распространения опасных устойчивых к антибиотикам штаммов бактерий в медицинских учреждениях.
cdc.gov
КОМПАНИЯ «GEDEON RICHTER» УДОСТОИЛАСЬ НАГРАДЫ ЗА ИННОВАЦИОННЫЙ АНТИПСИХОТИЧЕСКИЙ ПРЕПАРАТ
 Венгерский инновационный фонд (Hungarian Innovation Foundation) присудил компании «Gedeon Richter» гран-при за карипразин (Vraylar®/Reagila®), новый оригинальный венгерский препарат на мировом рынке.
Венгерский инновационный фонд (Hungarian Innovation Foundation) присудил компании «Gedeon Richter» гран-при за карипразин (Vraylar®/Reagila®), новый оригинальный венгерский препарат на мировом рынке.
Награда была вручена председателю компании «Gedeon Richter» Эрику БОГШУ (Erik Bogsch) Яношем ЛАТОРЦАИ (János Latorcai), вице-спикером Национального собрания Венгрии (Hungarian National Assembly), и Йожефом ПАЛИНКАШЕМ (József Pálinkás), председателем Национального бюро по исследованиям, развитию и инновациям (National Research, Development and Innovation Office).
Инновации всегда играли ключевую роль в стратегии развития компании «Gedeon Richter». За свою 117-летнюю историю компания вывела на рынок более 10 запатентованных лекарств, внеся значительный вклад в улучшение здоровья людей во всем мире. Инновации «Gedeon Richter» часто получали заслуженное признание.
Карипразин, удостоившийся награды за свою инновационность, представляет собой пероральный атипичный антипсихотик, разработанный венгерскими учеными компании «Gedeon Richter» и выведенный на глобальный рынок благодаря совместным усилиям компаний «Gedeon Richter» и «Allergan». В настоящее время карипразин имеет разрешение на маркетинг на более чем 70% территории глобального фармацевтического рынка.
FDA одобрило карипразин в форме капсул в сентябре 2015 г. для лечения пациентов с острыми маниакальными или смешанными эпизодами, связанными с биполярным расстройством I типа, а также для лечения шизофрении.
Европейская комиссия выдала лицензию на маркетирование карипразина в ЕС в июле 2017 г. Препарат продается в странах Европы под торговым названием Reagila® и предназначен для лечения пациентов с шизофренией. В нескольких странах ЕС в настоящее время ведутся переговоры о включении этого препарата в программу реимбурсации.
Изучение карипразина продолжается с целью оценки его эффективности по другим показаниям — у взрослых пациентов с биполярной депрессией и в качестве дополнительной терапии для лечения большого депрессивного расстройства.
Справка. Премия «Innovation Grand Prize» учреждена для признания венгерских компаний, внедряющих значимые и прибыльные инновации. Вручается ежегодно с 1993 г.
richter.hu
ОГРАНИЧЕНИЯ ОТНОСИТЕЛЬНО ПРИЕМА ВАЛЬПРОАТОВ ДЛЯ ЖЕНЩИН
 Координационная группа по взаимному признанию и децентрализованным процедурам (Group for Mutual Recognition and Decentralised Procedures – CMDh) одобрила новые меры, чтобы избежать влияния вальпроатов на внутриутробное развитие детей, поскольку у детей, подвергшихся такому влиянию во время беременности матери, повышается риск возникновения пороков развития.
Координационная группа по взаимному признанию и децентрализованным процедурам (Group for Mutual Recognition and Decentralised Procedures – CMDh) одобрила новые меры, чтобы избежать влияния вальпроатов на внутриутробное развитие детей, поскольку у детей, подвергшихся такому влиянию во время беременности матери, повышается риск возникновения пороков развития.
Таким образом, одобренные CMDh меры усиливают прежние ограничения относительно использования вальпроатов и требования к информированию о риске, связанном с их приемом для женщин.
Вальпроат содержащие лекарства были одобрены на национальном уровне в ЕС для лечения эпилепсии и биполярного расстройства, а в некоторых странах для профилактики мигрени. Новые меры включают запрет на применение этих лекарственных средств для лечения мигрени или биполярного расстройства во время беременности, а также запрет на лечение ими эпилепсии во время беременности, за исключением случаев, когда нет другого эффективного варианта терапии.
Кроме того, вальпроатсодержащие препараты не должны применяться у представительниц женского пола, способных к зачатию ребенка, при несоблюдении мер по предотвращению беременности в рамках новой программы. Эта программа предназначена для того, чтобы пациенты полностью осознавали риски и необходимость избегать беременности во время приема определенных лекарств.
Визуальное предупреждение о рисках, связанных с приемом вальпроатов во время беременности, также должно быть размещено на упаковке вальпроат содержащих препаратов.
Компании, продающие эти лекарства, должны проводить дополнительные исследования относительно характера и масштабов влияния рисков, связанных с приемом вальпроатов, контролировать применение этих лекарств и долгосрочные последствия их влияния на детей, чьи матери применяли вальпроаты во время беременности.
ema.europa.eu
Чем ознаменовался 2017 г. для глобального фармацевтического рынка?
 В целом 2017 г. выдался довольно успешным для фармацевтической индустрии по многим показателям. Основные фондовые индексы продемонстрировали прирост, чему в немалой степени способствовали американские политики, которые прекратили риторику о вмешательстве в ценообразование на лекарства и, наконец, продвинули налоговую реформу. Это рикошетом отобразилось на оптимизме инвесторов, в том числе венчурном финансировании, создав тем самым благоприятную среду для мелких разработчиков лекарств, работающих над инновационными технологиями. Стоимость акций ряда крупных и мелких фармацевтических и биотехнологических компаний возросла. Количество одобренных в США инновационных препаратов существенно увеличилось по сравнению с 2016 г., американский рынок пополнился рядом перспективных новинок с высоким потенциалом возврата инвестиций в них. Между тем ожидаемого всплеска M&A-активности компаний в 2017 г. так и не произошло — количество и стоимость сделок по слиянию и поглощению сократились по сравнению с предыдущим годом.
В целом 2017 г. выдался довольно успешным для фармацевтической индустрии по многим показателям. Основные фондовые индексы продемонстрировали прирост, чему в немалой степени способствовали американские политики, которые прекратили риторику о вмешательстве в ценообразование на лекарства и, наконец, продвинули налоговую реформу. Это рикошетом отобразилось на оптимизме инвесторов, в том числе венчурном финансировании, создав тем самым благоприятную среду для мелких разработчиков лекарств, работающих над инновационными технологиями. Стоимость акций ряда крупных и мелких фармацевтических и биотехнологических компаний возросла. Количество одобренных в США инновационных препаратов существенно увеличилось по сравнению с 2016 г., американский рынок пополнился рядом перспективных новинок с высоким потенциалом возврата инвестиций в них. Между тем ожидаемого всплеска M&A-активности компаний в 2017 г. так и не произошло — количество и стоимость сделок по слиянию и поглощению сократились по сравнению с предыдущим годом.
«ЦИКЛОН» НА ФОНДОВЫХ РЫНКАХ МИНОВАЛ К КОНЦУ ГОДА
Аналитики компании «Evaluate» отмечают, что надежды инвесторов биофармацевтической отрасли на восстановление фондового рынка в 2017 г. в значительной степени оправдались. Худшие опасения по поводу экономического влияния президентства Дональда Трампа не подтвердились, а риторика о снижении налогового бремени обеспечила «прояснение погоды» на фондовых рынках к концу 2017 г. Все основные фондовые индексы в США, Европе и Японии продемонстрировали рост по итогам 2017 г. (табл. 1), хотя и не достигли головокружительных высот 2015 г. При этом США, как и во многих других сферах, задают темп, что четко демонстрирует прирост топ-3 фондовых индексов по итогам 2017 г.
Таблица 1. Изменение основных фондовых индексов в течение 2017 г.*
| Основные фондовые индексы | Прирост за 12 мес 2017 г.,% |
| DJІА (США) | 25 |
| Nasdaq Biotechnology (США) | 21 |
| S&P 500 (США) | 19 |
| Thomson Reuters Europe Healthcare (ЕС) | 16 |
| Dow Jones Pharma and Biotech (США) | 15 |
| TOPIX Pharmaceutical Index (Япония) | 11 |
| S&P Pharmaceuticals (США) | 10 |
| FTSE-100 (Великобритания) | 8 |
| Euro STOXX 50 (ЕС) | 7 |
| Dow Jones STOXX Healthcare (ЕС) | 2 |
Среди представителей Большой Фармы, оказавшихся наиболее успешными на фондовых рынках в прошлом году, с большим отрывом лидировала компания «AbbVie» (табл. 2) благодаря отсрочке выхода на рынок биосимиляров ее блокбастера Humira (адалимумаб), предназначенного для лечения ревматоидного артрита.
Таблица 2. Топ-3 компаний — представителей Большой Фармы по темпам прироста стоимости акций по итогам 2017 г.*
| Компании | Прирост стоимости акций в 2017 г. по сравнению с 2016 г.,% | Рыночная капитализация, млрд дол. | |
| 2017 г. | Изменение за 12 мес | ||
| AbbVie | 54 | 154,4 | 52,6 |
| Astra Zeneca | 27 | 87,9 | 18,7 |
| Johnson & Johnson | 21 | 375,4 | 61,9 |
Несмотря на неудовлетворительные результаты клинического исследования Mystic для оценки эффективности препарата Imfinzi (дурвалумаб) в лечении рака легкого, компания «Astra Zeneca» заняла 2-е место среди представителей Большой Фармы по темпам прироста стоимости акций по итогам 2017 г.
Компания «Johnson & Johnson» добилась высокой производительности от своего фармацевтического подразделения, в том числе благодаря блокбастеру Zytiga (абиратерон), предназначенному для лечения рака предстательной железы. Лекарственное средство не только внесло существенный вклад в увеличение объема продаж компании, но и продемонстрировало свой потенциал для расширения показаний к применению.
Другими интересными для анализа группами компаний, работающих в сфере здравоохранения, являются таковые с более низкой рыночной капитализацией, в том числе так называемые компании Вне Большой Фармы. Повышение стоимости акций последних было более впечатляющим по сравнению с таковым представителей Большой Фармы (табл. 3).
Таблица 3. Лидеры по темпам прироста стоимости акций в 2017 г. в группах компаний, сформированных с учетом их рыночной капитализации*
| Группа компаний с учетом рыночной капитализации | Компании | Прирост стоимости акций в 2017 г. по сравнению с 2016 г., % | Рыночная капитализация, млрд дол. | |
| 2017 г. | Изменение за 12 мес | |||
| Компании с рыночной капитализацией более 25 млрд дол. | CSL | 44 | 49,8 | 14,9 |
| Takeda Pharmaceutical Company Limited | 32 | 44,8 | 8,0 | |
| Novo Nordisk | 31 | 132,1 | 56,2 | |
| Компании с рыночной капитализацией от 5 до 25 млрд дол. | Celltrion Healthcare | 106 | 24 | 12,9 |
| Vertex Pharmaceuticals | 103 | 37,9 | 19,6 | |
| Chugai Pharmaceutical | 72 | 28,6 | 10,5 | |
| Компании с рыночной капитализацией от 250 млн до 5 млрд дол. | Sangamo BioSciences | 438 | 1,386 | 1,171 |
| Esperion Therapeutics | 426 | 1,725 | 1,443 | |
| Nektar Therapeutics | 387 | 9,404 | 7,529 | |
Для начала попытаемся раскрыть секрет успеха лидеров в группе компаний с рыночной капитализацией более 25 млрд дол. США. В июле 2017 г. в США был одобрен препарат Haegarda (человеческий ингибитор С1-эстеразы) австралийской компании «CSL», предназначенный для предотвращения развития обострений наследственного ангионевротического отека у подростков и взрослых пациентов. Это можно назвать удачным ходом перед выведением на рынок ланаделумаба компании «Shire», предназначенного для лечения пациентов с наследственным ангионевротическим отеком. Считается, что именно одобрение Haegarda во многом стало причиной роста стоимости акций «CSL» по итогам 2017 г.
Успех новинки Victoza (лираглутид) на рынке антидиабетических лекарственных средств обеспечил рост стоимости акций «Novo Nordisk» с августа 2017 г. и превзошел все ожидания компании.
Уверенность инвесторов в стабильности компании «Takeda Pharmaceutical Company Limited», вероятно, обусловлена успехом ее противоопухолевых продуктов на рынке и надеждами на дальнейшее пополнение онкологического портфеля, что и обеспечило рост стоимости акций компании.
Среди компаний с рыночной капитализацией от 5 до 25 млрд дол. больших успехов добились азиатские производители. Южнокорейская «Celltrion Healthcare» выиграла от одобрения в ЕС биосимиляра препарата Herceptin — Herzuma (трастузумаб). Тем временем «Chugai Pharmaceutical», большая доля акций которой принадлежит компании «Roche», добилась успеха благодаря одобрению в США лекарственного средства Hemlibra (эмицизумаб), предназначенного для лечения кровотечений у пациентов с гемофилией A. Препарат также получил одобрение Европейского агентства по лекарственным средствам (European Medicines Agency — ЕМА) в феврале 2018 г.
Что же касается компании «Vertex Pharmaceuticals», то драйвером роста стоимости ее акций стало укрепление лидерских позиций в сегменте препаратов, предназначенных для лечения муковисцидоза, несмотря на усилия компании «AbbVie» составить ей конкуренцию в этом сегменте.
Прирост стоимости акций топ-3 среди компаний с рыночной капитализацией от 250 млн до 5 млрд дол. был наиболее впечатляющим. Так, стоимость акций компаний «Sangamo BioSciences» и «Esperion Therapeutics» выросла более чем на 400%, а «Nektar Therapeutics» — более чем на 300%. Последняя обязана интересом инвесторов к продукту в сфере иммуноонкологии NKTR-214. Несмотря на то что он находится на раннем этапе клинических исследований (фаза I), ожидается, что этот актив «Nektar Therapeutics» обладает многообещающим потенциалом в своей терапевтической области.
M&A-АКТИВНОСТЬ КОМПАНИЙ НА СПАДЕ
Интересен тот факт, что прирост стоимости акций фармацевтических и биотехнологических компаний произошел вопреки отсутствию высокой активности в сфере M&A-сделок на глобальном фармацевтическом рынке. Не секрет, что именно M&A-активность компаний зачастую является драйвером энтузиазма инвесторов. По данным компании «Evaluate», в 2017 г. было заключено 179 M&A-сделок, общая стоимость которых составила 80 млрд дол. (рис. 1). Таким образом, 2017 г. стал наиболее скудным в отношении количества сделок за последние 5 лет.
Рис. 1
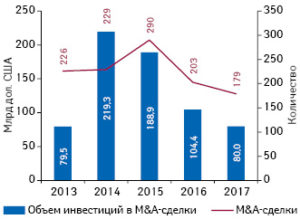 M&A-активность фармацевтических и биотехнологических компаний на мировом рынке за последние 5 лет и по итогам 2015 г.*
M&A-активность фармацевтических и биотехнологических компаний на мировом рынке за последние 5 лет и по итогам 2015 г.*
Вероятное объяснение этому — неопределенность в отношении налоговой реформы в США, что стало причиной отсутствия смелых стратегических шагов со стороны крупных компаний. К сокращению общей стоимости M&A-сделок в 2017 г. по сравнению с 2016 г. привело значительное уменьшение количества сделок с небольшой и средней стоимостью.
Наиболее крупной сделкой прошлого года считается приобретение американской компанией «Johnson & Johnson» европейской биотехнологической компании «Actelion Pharmaceuticals Ltd.» за 30 млрд дол. (табл. 4). По условиям сделки, «Actelion Pharmaceuticals Ltd.» выделит в самостоятельную компанию подразделение, занимающееся разработкой лекарств и проведением клинических исследований. Компания будет называться «R&D NewCo».
Таблица 4. Топ-10 наиболее крупных M&A-сделок, анонсированных в 2017 г.*
| Дата анонсирования сделки | Компания-покупатель | Целевая компания или подразделение | Стоимость сделки, млрд дол. |
| Январь | Johnson & Johnson | Actelion Pharmaceuticals Ltd. | 30 |
| Август | Gilead Sciences | Kite Pharma | 11,9 |
| Январь | Takeda Pharmaceutical Company Limited | Ariad Pharmaceuticals | 5,2 |
| Апрель | Fresenius Kabi | Akorn | 4,3 |
| Октябрь | Novartis | Advanced Accelerator Applications | 3,9 |
| Август | Bristol-Myers Squibb | IFM Therapeutics | 2,3 |
| Ноябрь | Shanghai Pharmaceuticals Holding | Дистрибьюторский бизнес компании Cardinal Health в Китае | 1,2 |
| Июль | Mitsubishi Tanabe Pharma | NeuroDerm Ltd. | 1,1 |
| Апрель | Sawai Pharmaceutical | Генерический бизнес Upsher-Smith Laboratories | 1,1 |
| Январь | Ipsen | Часть активов Merrimack Pharmaceuticals, включая ключевой продукт Onivyde (иринотекан) | 1 |
Второй наиболее крупной сделкой прошлого года стало приобретение компанией «Gilead Sciences, Inc.» компании «Kite Pharma, Inc.» по цене 180 дол. за акцию (общая сумма сделки — около 11,9 млрд дол.). Благодаря заключению этой сделки «Gilead Sciences, Inc.» осуществляет ожидаемое расширение бизнеса в направлении препаратов и технологий для лечения онкологических заболеваний.
В свою очередь, японская фармацевтическая компания «Takeda Pharmaceutical Company Limited» подписала соглашение о приобретении американской фармацевтической компании «Ariad Pharmaceuticals, Inc.» за 5,2 млрд дол. (24 дол. за акцию). Результатом данной сделки стало пополнение продуктового портфеля противоопухолевых препаратов компании «Takeda Pharmaceutical Company Limited» 2 инновационными разработками, предназначенными для таргетной терапии онкопатологии.
НОВИНКИ БЬЮТ РЕКОРДЫ
После провального 2016 г. в отношении количества одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) новинок в 2017 г. ситуация с выведением на рынок инновационных препаратов наладилась. По итогам 2017 г. FDA одобрило 57 новых малых молекул и биологических препаратов, что соответствует рекордному уровню 2015 г. (рис. 2). При этом обнадеживает тот факт, что аналитики «Evaluate» прогнозируют большое будущее новинкам в плане возврата инвестиций в них для компаний-разработчиков. Так, ожидается, что объем продаж одобренных FDA инновационных продуктов в 2017 г. через 5 лет после лонча составит 30,7 млрд дол. — рекордный показатель за последние годы, если прогнозы аналитиков «Evaluate» будут верны.
Рис. 2
Количество одобренных FDA инновационных лекарственных средств и объем их продаж в США через 5 лет после лонча за период 2008–2017 гг.*
Столь высоких результатов, как ожидается, удастся достигнуть в том числе благодаря потенциальным блокбастерам, увидевшим свет в прошлом году. Лидером среди топ-5 инновационных препаратов, одобренных FDA в 2017 г., по доходу от продаж через 5 лет после лонча, как ожидается, станет Ocrevus (окрелизумаб) компании «Roche», лекарственное средство, предназначенное для лечения рассеянного склероза, с объемом продаж 3,94 млрд дол. в 2022 г. (табл. 5). По прогнозам, ему будет наступать на пятки инновационный продукт компании «Sanofi» — Dupixent (дупилумаб), предназначенный для лечения экземы. Ожидается, что объем продаж этого препарата через 5 лет после лонча составит 3,56 млрд дол.
Таблица 5. Топ-5 инновационных препаратов, одобренных FDA в 2017 г., по объему продаж через 5 лет после лонча*
| № п/п |
Название препарата | Действующее вещество | Терапевтическая область применения | Компания | Объем продаж в США в 2022 г., млрд дол. |
| 1 | Ocrevus | Окрелизумаб | Рассеянный склероз | Roche | 3,94 |
| 2 | Dupixent | Дупилумаб | Экзема | Sanofi | 3,56 |
| 3 | Ozempic | Семаглутид | Сахарный диабет II типа | Novo Nordisk | 1,83 |
| 4 | Imfinzi | Дурвалумаб | Онкопатология | Astra Zeneca | 1,47 |
| 5 | Tremfya | Гуселькумаб | Псориаз | Johnson&Johnson | 1,22 |
Следует отметить, что в 2017 г. по ускоренной процедуре в США одобрено 2 препарата для CAR-T-клеточной терапии: Kymriah (тисагенлеклейсел) для лечения В-клеточного острого лимфобластного лейкоза и Yescarta (аксикабтаген cилолейcел) для лечения определенных типов В-клеточной лимфомы. Заявки на одобрение этих лекарственных средств были рассмотрены в среднем за 7,3 мес — рекордно короткий срок, начиная с 2013 г.
EMA в прошлом году рекомендовало к одобрению 92 лекарственных средства, 35 из которых содержали новые активные вещества, до сих пор не использовавшиеся в ЕС. Многие из этих лекарств предоставляют новые терапевтические возможности, в том числе для детей и лиц с орфанными заболеваниями. Из одобренных лекарственных средств 2 препарата относятся к средствам передовой терапии, 19 — орфанных препаратов, 7 лекарственных средств вышли на рынок по ускоренной процедуре, 3 получили условное разрешение на маркетирование, 2 — одобрение при исключительных обстоятельствах. В 51 случае было принято решение о расширении показаний к применению лекарственных средств.
Однако не только в сфере выведения на рынок инновационных препаратов удалось добиться успеха в 2017 г. Прошлый год стал рекордным по количеству одобренных FDA генериков. В частности, одобрение получили 1027 генериков, что на 214 больше, чем в 2016 г. Из них 843 были полностью одобрены и 184 получили предварительное одобрение, то есть они были одобрены с научной точки зрения, но пока не могут быть полностью одобрены из-за наличия патентов или эксклюзивности у оригинаторов. Прогрессу в сфере выведения на рынок генериков в США способствовал ряд законодательных инициатив.
В ЗАКЛЮЧЕНИЕ
Итак, в течение всего 2017 г. настроение инвесторов и многих фармацевтических и биотехнологических компаний было приподнятым, однако вопрос заключался в том, продолжатся ли хорошие времена для фармацевтического сектора в 2018 г. Начало года выдалось довольно обнадеживающим. После затишья в сфере M&A в 2017 г. ожидается некий всплеск активности компаний в этом направлении в 2018 г. Так, в январе уже произошло несколько крупных M&A-сделок: компания «Sanofi» приобрела акции «Ablynx» по 45 евро за акцию наличными (сумма сделки — около 3,9 млрд евро), а также компанию «Bioverativ» за 11,6 млрд дол. (105 дол. за акцию); «Celgene Corporation» объявила о приобретении частной компании «Impact Biomedicines» за 7 млрд дол. и компании «Juno Therapeutics, Inc.» за 9 млрд дол. (87 дол. за акцию наличными). Ожидается, что возможным препятствием для роста количества M&A-сделок будет переоценка компаниями стоимости своих привлекательных активов.
Светлана Шелепко,
по материалам
www.evaluategroup.com, www.fda.gov,
www.ema.europa.eu, www.thepharmaletter.com
*По данным аналитического отчета «Pharma, Biotech & Medtech 2017 in Review» компании «Evaluate».
Прием фторхинолонов способен навредить сосудам?
 Фторхинолоны — группа антибиотиков, которые назначаются при различных бактериальных инфекциях — от бактериального синусита до инфекций мочевых путей. Прием этих антибактериальных препаратов связан с тяжелыми побочными эффектами, поэтому следует соблюдать осторожность при их применении. Недавние данные теперь подтверждают, что фторхинолоны способны повышать риск развития заболеваний аорты, в частности речь идет об аневризме аорты и ее расслоении. Оба этих состояния могут быть опасными для жизни. Результаты исследования опубликованы в журнале «BMJ».
Фторхинолоны — группа антибиотиков, которые назначаются при различных бактериальных инфекциях — от бактериального синусита до инфекций мочевых путей. Прием этих антибактериальных препаратов связан с тяжелыми побочными эффектами, поэтому следует соблюдать осторожность при их применении. Недавние данные теперь подтверждают, что фторхинолоны способны повышать риск развития заболеваний аорты, в частности речь идет об аневризме аорты и ее расслоении. Оба этих состояния могут быть опасными для жизни. Результаты исследования опубликованы в журнале «BMJ».
В рамках исследования ученые из Каролинского института (Karolinska Institutet), Университета Лунда (Lund University), Швеция, и Датского государственного института сывороток (Statens Serum Institut) сравнили риск развития заболеваний аорты у более 360 тыс. испытуемых, получавших фторхинолоны (в 78% случаев ципрофлоксацин), с таковым у равного количества участников, получавших антибиотик из другой группы — амоксициллин.
ПОЗНАВАТЕЛЬНО:

Какая работа сопряжена с повышением артериального давления и холестерина в крови?
Исследователи сообщают, что по сравнению с группой участников, принимавших амоксициллин, у принимавших фторхинолоны риск развития аневризмы аорты/расслоения аорты повышался на 66%. В течение 60-дневного периода повышенного риска частота случаев аневризмы/рассечения аорты составила 1,2 на 1000 человек, среди тех, кто принимал фторхинолоны, и 0,7 на 1000 человек среди принимавших амоксициллин.
По мнению ученых, основополагающим механизмом взаимосвязи между применением фторхинолонов и заболеваниями аорты может быть то, что эти антибиотики активируют функции определенных ферментов, известных как матриксные металлопротеиназы, которые могут повредить целостность внутренних тканей. Данный механизм также считается виновником другого побочного эффекта этой группы антибиотиков — разрыва сухожилий.
Исследователи подчеркивают необходимость проведения дальнейших исследований в этой области для выяснения того, являются ли конкретные виды антибиотиков фторхинолонового ряда более опасными для здоровья сосудов, чем другие. Также требуется уделить внимание изучению механизмов, посредством которых осуществляется повреждение сосудов в рамках выявленной ассоциации.
По материалам www.medicalnewstoday.com